COVID-19-diagnostiikka ja sen osuvuus
Koronatestejä tehdään yhä enemmän. Mutta miten akuutissa vaiheessa käytettävät PCR-testit tai myöhemmin vasta-aineet osoittavat testit toimivat – ja mitä niistä ei voi päätellä?
Uuden koronaviruksen, SARS-CoV-2:n aiheuttamien infektioiden torjumiseksi tehdyt rajoitustoimet ovat olleet ennennäkemättömiä. Myös testausmäärät taudin havaitsemiseksi ovat muutamassa kuukaudessa kasvaneet huimiksi. Testaus on yksi lenkki ketjussa, jolla varmistetaan tartunnan saaneiden tunnistaminen, eristäminen ja karanteeniin määrääminen, altistuneiden kartoittaminen sekä tartuntaketjujen katkaiseminen (1).
PCR-testit akuuttiin diagnostiikkaan
Tammikuussa tunnistetun uuden viruksen osoittamiseksi kehitettiin nopeasti spesifisiä nukleiinihapon osoittamiseen perustuvia PCR-testejä. Suomessa on tätä kirjoitettaessa tehty lähes 180 000 testiä ja positiivinen tulos on saatu 6 776 tapauksessa.
Suomessa käytössä oleva PCR-testi (2) on vakiintunut kansainvälisesti COVID-19-diagnostiikkaan, ja myös WHO (3) suosittelee sitä. Sen herkkyydeksi on saatu 95 %, eikä ristireaktioita muiden kausikoronavirusten kanssa havaittu (2). Testi on myös useassa suomalaisessa laboratoriossa havaittu teknisesti erittäin toimivaksi. Testiä tehdään omavalmistuksena (in-house) toimiluvallisissa kliinisen mikrobiologian laboratorioissa. Tämän lisäksi käytössä on kaupallisia PCR-testejä.
Näytteenoton haasteita
Koronatestaus, kuten mikään muukaan laboratoriotestaus, ei ole absoluuttisen varmaa kaikissa tilanteissa. Haasteita liittyy erityisesti preanalytiikkaan.
Näytteenoton ajoitus optimaaliseen viruksen erittymisaikaan on yksi haaste. Ei tarkkaan tiedetä, kuinka kauan ennen oireiden alkua virusta olisi PCR-testillä osoitettavissa.
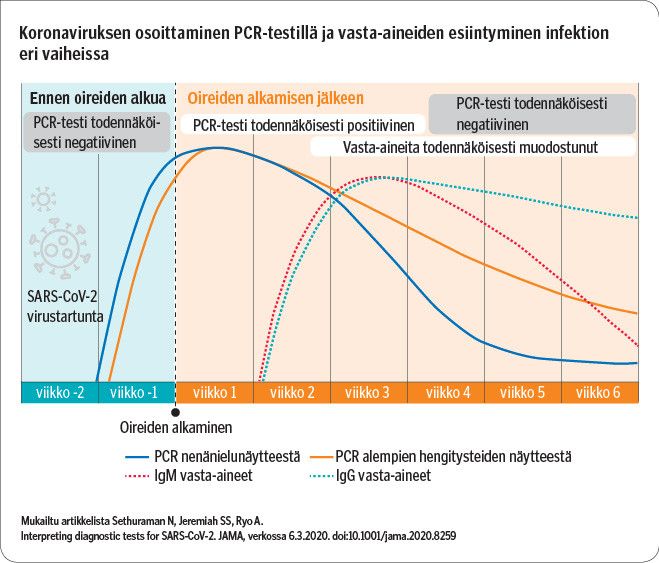
Nykytiedon mukaan viruseritys ja löydettävyys PCR-testillä on suurimmillaan oireiden juuri alkaessa (kuvio). Virusta voidaan PCR-testillä osoittaa parhaimmillaan useita viikkoja oireiden alkamisesta. Kuitenkaan tällöin henkilöä ei enää pidetä tartuttavana, eikä lieväoireisen infektion jälkeen kontrollinäytteiden ottamista pidetä tarpeellisena.
Näytteenotto tapahtuu samoin kuin muissa hengitystieinfektioissa: syvältä nenänielun takaosasta näytteenottotikulla limakalvon pintaa kaapien, jotta epiteelisolukkoa saadaan näytteeseen. Näyte voidaan ottaa myös nielusta, esimerkiksi potilailta, joilla on taipumusta nenäverenvuotoon. Nielunäytteenottoa on käytetty myös tilanteissa, joissa näytteenottovälineistä on ollut pulaa. Myös helposti otettavia sylkinäytteitä on käytetty, mutta viestit niiden toimivuudesta ovat olleet ristiriitaisia. Suomessa sylkinäytteen käyttöä testataan parhaillaan.
Miten suhtautua negatiiviseen tulokseen?
Negatiivinen tulos kertoo siitä, että näytteenottohetkellä potilaalla ei käytetyllä analyysimenetelmällä voitu otetusta näytteestä osoittaa koronavirusta. On huomioitava, että inkubaatioaika (1–14 vrk) on saattanut olla meneillään, mutta virus ei vielä näkynyt testissä. On myös mahdollista, että näytteenotto ei ole onnistunut ja tulos jää siksi negatiiviseksi.
Lisäksi on havaittu, että potilaan oireiden ollessa alahengitysteissä, ylähengitysteistä otettu näyte saattaa jäädä negatiiviseksi. Tällainen tilanne on tyypillisesti vakavaoireisella, sairaalahoitoa tarvitsevalla potilaalla. Tällöin suositellaan näytteenottoa alahengitysteistä, esimerkiksi huuhtelunäytettä (BAL).
Väärien negatiivisten tulosten osuutta kaikista analyyseistä on vaikeaa arvioida. Uusintanäytteenottoa suositellaan epäselvissä tilanteissa.
Vasta-ainetestit toimivat myöhemmin
Verinäytteestä tehtävällä vasta-ainetestillä voidaan osoittaa, esiintyykö näytteessä vasta-aineita SARS-CoV-2-virusta vastaan ja siten arvioida, onko henkilö aiemmin saanut COVID-19-tartunnan. Vasta-aineita kehittyy keskimäärin kahden viikon viiveellä oireiden alkamisesta (kuvio), jolloin noin puolella tartunnan saaneista vasta-aineita on muodostunut.
Vasta-ainetesti näyttää positiivisen tuloksen vasta, kun infektio on jatkunut pidempään tai kun henkilö on jo parantunut. Tämän vuoksi vasta-ainetestit eivät sovellu akuutin taudin toteamiseen.
COVID-19-infektion saaneilla IgM-luokan vasta-aineita ei ole havaittavissa juurikaan IgG-vasta-aineita aikaisemmin, mutta IgG-vasta-aineiden pitoisuus suurenee pidempään ja pysyy suurentuneena pidempään.
Vasta-aineita voidaan mitata seerumi-, plasma- tai sormenpääverinäytteestä. Testit mittaavat vasta-aineita SARS-CoV-2-viruksen rakenneproteiineja eli antigeeneja vastaan. Tällainen antigeeni on esimerkiksi viruksen pinnan piikkiproteiini. Viruksen sisällä oleva nukleoproteiini on myös hyvin immunogeeninen eli aktivoi kyseisen rakenteen tunnistavia immuunipuolustuksen soluja. Useimmat kaupalliset vasta-ainetestit perustuvat joko viruksen piikkiproteiiniin, nukleoproteiiniin tai molempiin.
Vasta-ainepikatestit ovat raskaustestin kaltaisia immunokromatografisia liuskatestejä, joissa näyte voidaan tutkia sormenpäästä otettavasta verinäytteestä, seerumi- tai plasmanäytteestä. Pikatestin tulos on luettavissa nopeasti. Laboratoriossa tehtävillä testeillä, kuten entsyymi-immunologisella eli ELISA-testillä, voidaan seerumi- tai plasmanäytteestä mitata vasta-aineiden määrää kvantitatiivisesti tai semikvantitatiivisesti. Kaupallisten vasta-ainetestien laadussa on paljon vaihtelua.
Neutraloivia vasta-aineita mittaavalla testillä voidaan luotettavimmin todeta COVID-19-infektion seurauksena muodostuneita vasta-aineita. Neutraloivat vasta-aineet estävät viruksen kiinnittymisen solun reseptoriin ja viruksen pääsemisen solun sisään. Virusta neutraloivat vasta-aineet kohdistuvat etenkin viruksen piikkiproteiineihin.
Yksittäinen vasta-ainetesti ei riitä nykytilanteessa
Parittaisista akuutin ja toipilasvaiheen verinäytteistä on periaatteessa mahdollista tutkia vasta-aineiden määrän lisääntymistä ja siten arvioida COVID-19-infektion mahdollisuutta tilanteessa, jossa taudinaiheuttaja on jäänyt selvittämättä.
Yksittäisestä verinäytteestä tehtävä vasta-ainetesti ei anna luotettavaa tulosta silloin, kun taudinaiheuttajan yleisyys väestössä on vähäinen. Mitä harvinaisempi on todellisen positiivisen testituloksen mahdollisuus, sitä suurempi on väärän positiivisen tuloksen todennäköisyys. Tällä hetkellä vain pienellä osalla väestöstä on koronaviruksen vasta-aineita eli seroprevalenssi Suomen väestössä on hyvin pieni, alle yhden prosentin (4).
Väärän tuloksen riskiin vaikuttaa myös käytetyn vasta-ainetestin suorituskyky eli testin herkkyys ja tarkkuus. Herkkyys tarkoittaa sitä, kuinka suuresta osasta infektion sairastaneiden henkilöiden näytteitä testi tunnistaa vasta-aineita. Tarkkuus tarkoittaa sitä, millä todennäköisyydellä testi antaa negatiivisen tuloksen näytteestä, kun henkilö ei ole sairastanut kyseistä infektiota.
Jos vasta-ainetestin tarkkuus on esimerkiksi 98 % ja väestön todellinen seroprevalenssi 0,5 %, testillä saaduista positiivisista tuloksista todennäköisesti kolme neljästä olisi vääriä. Tällöin testi voi tunnistaa esimerkiksi toisen koronavirusinfektion seurauksena muodostuneita vasta-aineita.
Yksittäisen vasta-ainetestin perusteella ei voida nykyisessä epidemiatilanteessa luotettavasti arvioida, onko henkilö sairastanut COVID-19-infektion. Tällä hetkellä vasta-ainetestit soveltuvat ainoastaan seroepidemiologiseen tutkimuskäyttöön, kun arvioidaan tartuntojen määrää väestössä tai tietyissä kohderyhmissä.
Immuniteetista ei toistaiseksi varmuutta
Vasta-ainetestien perusteella ei myöskään voida päätellä, onko henkilö suojassa uudelta tartunnalta. Suurimmalle osalle taudin sairastaneista muodostuu neutraloivia vasta-aineita, joilla todennäköisesti on merkitystä suojassa virustartuntaa vastaan. Myös ei-neutraloivat vasta-aineet ja T-soluihin perustuva soluvälitteinen immuniteetti voivat vaikuttaa suojaan.
Useissa tutkimuksissa on havaittu, että sairastetun taudin vakavuus voi vaikuttaa muodostuvan immuniteetin voimakkuuteen siten, että lieväoireisessa infektiossa vasta-ainevaste jää heikommaksi. Toistaiseksi ei ole varmaa tutkimustietoa siitä, millainen immuniteetti suojaa uudelta tartunnalta ja kuinka kauan se säilyy.
- 1
- STM. Suomi lisää koronavirustestausta merkittävästi. https://stm.fi/artikkeli/-/asset_publisher/krista-kiuru-suomi-lisaa-koronavirustestausta-merkittavasti
- 2
- Corman VM, Landt O, Kaiser M ym. Detection of 2019 novel coronavirus (2019-nCoV) by real-time RT-PCR. Euro Surveill 2020;25(3):2000045. doi: 10.2807/1560-7917.ES.2020.25.3.2000045.PMID: 31992387
- 3
- WHO. Molecular assays to diagnose COVID-19: Summary table of available protocols 24 January 2020- https://www.who.int/who-documents-detail/molecular-assays-to-diagnose-covid-19-summary-table-of-available-protocols
- 4
- THL. THL alkaa julkaista väestötutkimuksen koronavirusvasta-ainetuloksia viikoittain. https://thl.fi/fi/-/thl-alkaa-julkaista-vaestotutkimuksen-koronavirusvasta-ainetuloksia-viikoittain