Virusdiagnostiset menetelmät: viljely, antigeeninosoitus vai nukleiinihaponosoitus?
• Nukleiinihapon osoitusmenetelmät ovat yleistyneet nopeasti virusdiagnostiikassa herkkyytensä vuoksi. Käytännössä ne ovat korvanneet diagnostiset virusviljelytutkimukset.
• Vieritestauksessa käytetään yleisesti myös helppokäyttöisiä antigeeninosoitustestejä, mutta niiden suorituskyky vaihtelee.
• Ns. pika-PCR-testit mahdollistavat nopeaa hoitoa varten tarvittavan pikadiagnostiikan esimerkiksi päivystysten tarpeisiin.
• Menetelmät kehittyvät ja vaatimukset diagnostisille testeille kasvavat jatkuvasti, kuten käynnissä oleva koronapandemiakin on osoittanut. Uusien teknologioiden kehitystä tulee jatkuvasti seurata ja analysoida.

Viime vuosikymmenien aikana kehittyneet molekyylibiologiset menetelmät ovat nopeasti yleistyneet virusdiagnostiikan käyttöön muita menetelmiä paremman herkkyytensä vuoksi. Tässä artikkelissa käsitellään perinteisten menetelmien sekä nukleiinihapon osoitusmenetelmien ominaisuuksia sekä niiden soveltuvuutta käypään virusdiagnostiikkaan.
Virusviljely
Viljely oli pitkään virusdiagnostiikan kulmakivi. Virusviljelyssä viruksen annetaan lisääntyä soluviljelmässä, jolloin se aiheuttaa solukkoon valomikroskoopilla havaittavan solumuutoksen, ns. sytopaattisen efektin (CPE). Virus tunnistetaan tämän jälkeen joko värjäämällä solukko spesifisillä virusvasta-aineilla tai nukleiinihappotekniikoiden avulla.
Virusviljely on herkkä menetelmä, sillä jo yksi infektiokykyinen viruspartikkeli riittää aloittamaan infektion soluviljelmässä, mutta menetelmä on altis mm. epäsuotuisille säilytys- ja kuljetusolosuhteille. Viljelyä varten potilasnäyte tulee ottaa viruskuljetusnestettä sisältävään putkeen ja kuljettaa laboratorioon nopeasti ja oikeassa lämpötilassa, jotta virukset säilyvät infektiokykyisinä.
Menetelmä on työläs ja se vaatii laboratoriossa erilliset puhdastilat sekä henkilökunnalta erikoisosaamista. Lisäksi se on hidas: laajassa virusviljelyssä negatiivisen tuloksen saaminen voi kestää jopa 2–3 viikkoa. Herpes simplex 1- ja 2 -viruksen ja sytomegaloviruksen diagnostiikkaan on käytössä pikaviljelymenetelmät, joista vastaus saadaan 1–7 vuorokauden viljelyn jälkeen.
Virusviljely puoltaa kuitenkin edelleen paikkaansa joissain tilanteissa. Esimerkiksi elinsiirtopotilaiden sytomegalovirustaudissa virusta ei välttämättä erity lainkaan verenkiertoon eikä sitä voida osoittaa plasmasta kvantitatiivisella PCR-menetelmällä, mutta pikaviljelyllä infektiivistä virusta voidaan osoittaa potilaan eritteistä tai kudosnäytteistä.
Virusviljelyn ehdottomana etuna on, että se löytää näytteessä olevan elävän viruksen. Elävän viruksen läsnäolo näytteessä osoittaa aktiivisen virusinfektion.
Virusantigeenin osoitustestit
Antigeeninosoitusmenetelmässä viruksen antigeenejä (usein viruksen pintaproteiineja) tunnistetaan näytteestä virusspesifisten mono- tai polyklonaalisten vasta-aineiden avulla immunofluoresenssivärjäyksellä, immunokromatografisilla pikatesteillä tai EIA-menetelmin. Antigeeninosoitukseen perustuvia pikatestejä on kaupallisesti saatavilla useita, ja tyypillisesti testit ovat helppokäyttöisiä ja nopeita, ja siksi niitä käytetään vieritestaukseen erilaisissa toimintayksiköissä.
Laboratorioiden toimintaolosuhteet ja mm. henkilöstöresurssit vaikuttavat käytettävien testien valintaan. Lisäksi testien herkkyydet ja tarkkuudet vaihtelevat suuresti ja diagnostiikassa tarvittava suorituskyky – useimmiten herkkyys – vaikuttaa testin valintaan. Tämän vuoksi on tärkeää, että laboratorio verifioi itse testin ennen sen käyttöönottoa ja todentaa valmistajan ilmoittaman herkkyyden ja tarkkuuden omassa potilasnäyteaineistossaan ja arvioi, soveltuuko kyseinen testi suunniteltuun käyttötarkoitukseen.
Antigeeninosoitustestien herkkyys on heikompi kuin nukleiinihapon osoitustestien, koska nukleiinihapon osoitustesteissä nukleiinihappoa monistetaan ennen sen osoittamista. Antigeeninosoitustestien heikompi herkkyys voi johtua myös siitä, että testi ei tunnista kaikkia viruksen kiertäviä kantoja.
Esimerkiksi noroviruksen luontainen muuntelevuus ja lukuisat genotyypit ovat johtaneet siihen, että yksittäisellä antigeeninosoitustestillä ei saavuteta kliinisesti hyväksyttävää herkkyyttä. Herkkyyden on todettu jäävän välille 35–64 % antigeeninosoitukseen perustuvilla pikatesteillä (1,2,3,4). Myös influenssavirustestien herkkyys immunokromatografisilla antigeeninosoituspikatesteillä on kehno etenkin aikuispotilailla: meta-analyysissä influenssa A -virukselle 54,4 % ja influenssa B -virukselle 53,2 % (5). Koronavirustaudin osoitukseen käytettyjen antigeenitestien suorituskyky vaihtelee myös suuresti, herkkyys on ollut välillä 30–94 % (6).
Noroviruksen ja influenssan selvittelyssä Suomessa on siirrytty suurelta osin nukleiinihappopohjaiseen diagnostiikkaan testien paremman herkkyyden ja tarkkuuden vuoksi, mutta rota- ja adenovirusinfektioiden diagnostiikassa antigeeninosoitustestit ovat edelleen käytössä.
Nukleiinihapon osoitustestit
Virusdiagnostiikka on kehittynyt viime vuosina nopeasti molekyylibiologisten menetelmien ansiosta. Virologiassa etenkin PCR-menetelmät ovat laajassa käytössä. Niiden etuna on se, että ne ovat herkkiä, tarkkoja ja automatisoitavissa.
Nukleiinihapon osoitusmenetelmät ovat käytännössä lähes korvanneet työläät ja hitaat virusviljelytutkimukset. PCR-menetelmien avulla voidaan myös tunnistaa viruksia, joita ei kyetä virusviljelyssä kasvattamaan. Testit vaativat kuitenkin erityistiloja, huolellisia toimintatapoja sekä perehtyneisyyttä.
Kliinisen mikrobiologian laboratorioissa on käytössä joko puoliautomaattisia nukleiinihaponosoitustestejä eri laitealustoilla (nukleiinihappojen eristyslaite ja reaaliaikainen monistuslaite erikseen) tai täysautomaattisia nukleiinihappoanalysaattoreita. Mikäli näytettä joudutaan esikäsittelemään analyysiä varten, se tehdään biosuojakaapissa näytteenkäsittelytilassa.
Nukleiinihappoanalytiikassa käytetään joko kaupallisia, CE-IVD-merkittyjä testikittejä tai laboratorion omavalmisteisia ns. in-house-testejä. Omavalmisteisia testejä käytetään, koska kaikille virusryhmille ei ole saatavilla kaupallisia testejä. Laboratorio tutkii ja varmistaa in-house-testien suorituskyvyn ja soveltuvuuden käyttötarkoitukseensa (validoi) edustavalla potilasnäyteaineistolla ennen testin käyttöönottoa.
Kvantitatiivisina versioina nukleiinihapon osoitusmenetelmät mahdollistavat viruksen määrän mittaamisen. Niitä käytetään yksin tai yhdessä kvalitatiivisen testin kanssa tartuttavuuden selvittämiseen, hoitovasteen seurantaan HIV-, HBV- ja HCV-infektioissa sekä esimerkiksi immuunipuutteisten potilaiden CMV-, EBV- ja polyoomavirusinfektioissa.
Nukleiinihappotestit ovat joko yksittäisten virusten tunnistamiseen suunniteltuja testejä tai monianalyyttisiä ns. multiplex-testejä, joita käytettäessä samassa testiajossa voidaan todentaa useamman virusnukleiinihapon läsnäolo potilasnäytteessä. Monianalyyttisissä testipaneeleissa haetaan usein oireyhtymäpohjaisesti aiheuttajamikrobia (esim. ripulia ja hengitystieinfektioita tai keskushermostoinfektioita aiheuttavia mikrobeja), ja tällöin mukana voi olla myös bakteereita, sieniä tai alkueläimiä. Suorituskyky saattaa olla jollekin testipaneelin mikrobille huonompi kuin yksittäisten PCR-testien (7,8), koska monianalyyttisissä testeissä testiolosuhteissa on jouduttu tekemään kompromisseja.
Nopeasti käyttöön
Uusien virusten ilmaantuessa nukleiinihapon osoitusmenetelmät saadaan nykyisin nopeasti diagnostiikan käyttöön. Kun WHO raportoi tammikuun alkupuolella 2020 Wuhanin maakunnassa Kiinassa esiintyvistä keuhkokuumetapauksista, joiden aiheuttajaksi oli vahvistettu uusi koronavirus SARS-CoV-2, ensimmäinen nukleiinihapon osoitusmenetelmä viruksen tunnistamiseksi julkaistiin jo tammikuussa (9) ja WHO suositteli tämän testin käyttöä viruksen diagnostiikkaan.
Tietojen avulla kliinisen mikrobiologian laboratoriot pääsivät pystyttämään diagnostiset SARS-CoV-2-in-house-testinsä viruksen tunnistamiseksi potilasnäytteistä. Hieman myöhemmin markkinoille saatiin useita kaupallisten valmistajien CE-IVD-merkittyjä testikittejä. Kaupalliset testit toimivat useilla erilaisilla laitealustoilla ja ovat automaatioasteeltaan erilaisia.
Nukleiinihaponosoitustesti sisältää useita vaiheita: näytteen laadun ja pyyntötarrojen esitarkastelu ja tietojen vieminen laboratorion tietojärjestelmään, näytteiden järjestäminen analyysiä varten, näytteen inaktivointi, mikäli kyseessä on tartuntavaarallinen patogeeni, nukleiinihappojen eristys, nukleiinihappojen monistusvaihe, tulosten tarkastelu, analysointi ja vastaaminen. Tavanomaiset testit vievät aikaa tyypillisesti 3–5 tuntia, pikatestiversiot 1–2 tuntia siitä, kun näytteet on saatu laboratorioon analyysiin.
Nopeat nukleiinihaponosoitustestit
Viime vuosina diagnostiseen käyttöön on tullut nopeita nukleiinihaponosoitustestejä, ns. POC-PCR-kasettitestejä (point of care PCR), jotka mahdollistavat nopean diagnostiikan esimerkiksi päivystyksessä. Suomessa tällaiset influenssa- ja RSV-testit ovat olleet jo laajasti käytössä, ja nyt pikatestausmahdollisuuksia on kohennettu koronavirusdiagnostiikassa sijoittamalla POC-testilaitteita päivystävien sairaaloiden laboratorioihin, joissa analytiikkaa voidaan tehdä ympäri vuorokauden. Pikatestit mahdollistavat nopean diagnostiikan esimerkiksi osastohoitoon otettavien potilaiden kohortoimiseksi tai päivystysleikkaukseen menevien potilaiden koronavirusinfektion poissulkemiseksi.
POC-PCR-testissä potilasnäyte pipetoidaan testikasettiin, joka sisältää kaikki nukleiinihappojen eristämiseen ja monistamiseen vaadittavat reagenssit. Näytteen lisäämisen jälkeen testikasetti suljetaan ja viedään laitteelle, joka suorittaa nukleiinihappojen eristämisen, monistamisen ja tulosten analysoinnin. Usein nämä testit ovat monianalyyttisiä, joten vastaus saadaan useammasta viruksesta samanaikaisesti. Yhden monianalyyttisen testikasetin hinta on varsin korkea, joten testin käyttö kohdennetaan yleensä niihin potilasryhmiin, joille on kliinisesti tärkeää saada nopea diagnoosi.
POC-PCR-testien suorituskyky vaihtelee, ja laboratorion tulee selvittää testin ominaisuudet ennen käyttöönottoa ja arvioida testin käyttökelpoisuus. Jo pidempään käytössä olleiden kaupallisten influenssa- ja RSV-POC-PCR-testien suorituskyky on yleisesti hyvä: kuuden valmistajan testien vertailussa herkkyydet olivat erinomaiset (influenssa A 98,6–100 %, influenssa B 85,4–100 %) ja tarkkuudet samoin (influenssa A 99,3–100 % ja influenssa B 97,7–100 %) (10). Myös koronavirustaudin diagnostiikkaan käytettävät POC-PCR-testit ovat varsin hyviä (11,12). Norovirusdiagnostiikkaan on niin ikään saatavilla useita kaupallisia testejä, jotka soveltuvat infektioiden toteamiseen (13,14). Ripulin pikadiagnostiikkaan on nykyisin saatavilla myös monianalyyttisiä kasettitestejä, joissa ripulia aiheuttavia mikrobeja tunnistetaan kattavasti. Näiden testien soveltuvuus diagnostiseen käyttöön on myös arvioitu (15) ja todettu hyväksi.
Vaikka POC-PCR-testien suorittaminen on helppoa, vaativat nämäkin testit kontaminaatioiden estämiseksi ja työturvallisuuden varmistamiseksi riskinarvioon perustuvat järjestelyt ja tilat. Huomioon tulee ottaa tutkittavan mikrobin riskiluokka ja sen edellyttämät tilat ja varustelutaso, mutta myös PCR-työskentelyhygienia kontaminaatioiden estämiseksi. Mikäli POC-PCR-testejä tehdään laboratorion ulkopuolella hoitoyksiköissä, sielläkin tulee huomioida näytteen käsittelyyn ja tilajärjestelyihin liittyvät vaatimukset.
Yleisesti käytetään vähintään BSL-2-tason laboratoriotiloja ja tarvittaessa erillisiä tiloja näytekäsittelylle ja laitteille. Näytteet esikäsitellään ja pipetoidaan biosuojakaapissa. Analytiikassa pyritään hyödyntämään laiteliitäntöjä, joissa analysaattorilta valmistuneet tulokset siirretään suoraan laboratoriotietojärjestelmään ja sieltä autoverifiointisääntöjen mukaisesti potilastietojärjestelmään. Tällöin tulokset ovat hoitavan lääkärin käytettävissä mahdollisimman nopeasti ja tiedonsiirron virheet voidaan minimoida.
POC-PCR-testit eivät ole massatestejä. Tyypillisesti pikatestilaitteistolla voidaan tutkia kerrallaan 1–16 näytettä ja ajoaika laitteessa vaihtelee vajaasta tunnista noin 1,5 tuntiin.
Laadunvarmistus ja toimintavarmuus
Laboratorion laadunvarmistuksesta huolehditaan kokonaisvaltaisesti etukäteen pohditulla ja suunnitellulla toimintajärjestelmällä. Analytiikan laatua seurataan sekä sisäisillä kontrolleilla että ulkoisilla laadunvarmistusnäytteillä. Potilasdiagnostiikkaan käyttöön otettavat laitteet verifioidaan aina ennen varsinaista käyttöönottoa. Tärkeässä roolissa testien käyttöönoton yhteydessä on henkilökunnalle laadittava ohjeistus ja koko prosessiin annettava perehdytys.
Kontaminaatioiden estäminen on oleellista käytettäessä nukleiinihappotestejä laboratoriodiagnostiikassa (16). Kontaminaatioiden todennäköisyys kasvaa tutkimusmäärien lisääntyessä, joten jokainen laboratorio suunnittelee toimintansa ja tilansa riskinarvion perusteella.
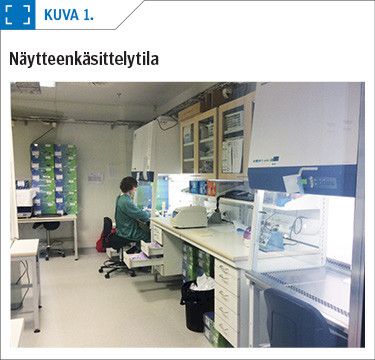
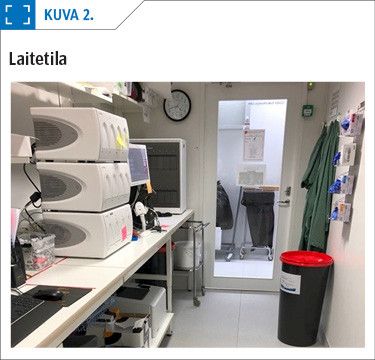
Lähtökohtana kontaminaatioiden estossa on laboratoriotilojen suunnittelu siten, että laboratoriossa on erikseen pre-PCR- ja post-PCR-tilat, tarvittaessa yli- ja alipainejärjestelyin. Näytteiden käsittely nukleiinihappoanalytiikkaan tehdään BSL-2-turvatason tilassa biosuojakaapissa näytteenkäsittelyhuoneessa (kuva 1) Viruksen genomin tai sen osan monistaminen tapahtuu erillisessä laitehuoneessa (kuva 2).
Näytteen käsittelyä varten työntekijät pukeutuvat suojavaatteisiin ja noudattavat työskennellessään aseptisia työtapoja. Potilasnäytteet sisältävät viruspartikkeleita, jotka voivat levitä aerosolimuodossa näytteestä toiseen esimerkiksi näytteenkäsittelyvaiheessa, mikäli useita näyteputkia tai kasetteja käsitellään samanaikaisesti. Siirtymää putkesta toiseen voi tapahtua myös käsien tai pipettien kautta. Tämän vuoksi aseptiset työskentelytavat tulee huolellisesti perehdyttää henkilökunnalle.
Pahin kontaminaatiotilanne syntyy silloin, kun monistettua tuotetta pääsee leviämään laitetilasta muihin tiloihin. Jätteiden käsittely, varastointivaihe ja poistaminen tulee suunnitella siten, ettei siitä aiheudu kontaminaatiovaaraa. Huonetilojen ja biosuojakaapin puhdistuksessa käytetään viruksia ja nukleiinihappoja tuhoavia puhdistusaineita. Tilassa käytetään työskentelyn jälkeen UV-valoa tuhoamaan mikrobeja ja hajottamaan nukleiinihappoja.
Kontaminaatioiden estossa henkilökunnan perehdytys on avainasemassa. Kirjallinen ja suullinen ohjeistus työtavoista, huolellinen perehdyttäminen ja toimintatapojen pysyvyyden varmistaminen ovat tärkeitä keinoja. Laboratoriossa tulee myös tutkia säännöllisesti kontrollinäytteitä puhtausasteen varmistamiseksi.
Testausta voi rajoittaa testien ja tarvikkeiden saatavuus. Parhaillaan meneillään olevassa koronaepidemiassa laboratoriot käyttävät pitkälti samoja testejä kaikkialla maailmassa, ja testien ja tarvikkeiden kysyntä on ylittänyt tarjonnan moninkertaisesti. Näitä tilanteita varten tulee olla varautumissuunnitelma, ja etenkin isoilla laboratorioilla on hyvä olla useampia tuotantolinjoja testitulosten tuottamiseksi. Varautumisesta huolimatta testi- ja tarvikepula on koronapandemian aikana realisoitunut ja esimerkiksi niukat saatavilla olevat POC-PCR-testikasetit joudutaan varaamaan kaikkein kriittisimpien potilasryhmien diagnostiikkaan.
Kliinisen mikrobiologian toimilupamenettely
Tartuntatautilaki säätelee mikrobiologisten laboratoriotutkimusten suorittamista (17). Tartuntatautien toteamiseksi ja torjumiseksi tarkoitettu potilasnäytediagnostiikka on luvanvaraista toimintaa. Toimilupamenettelyn tarkoitus on varmistaa, että mikrobiologista diagnostiikkaa tekee Suomessa ammattitaitoinen henkilökunta asiallisissa tiloissa ja asianmukaisia menetelmiä käyttäen. Toimilupamenettely koskee kaikkia sellaisia tutkimuksia, jotka tähtäävät mikrobietiologian selvittämiseen.
Mikrobiologista analytiikkaa voidaan tehdä vain tähän tarkoitukseen toimiluvan saaneissa laboratorioissa ja niiden valvomissa toimintayksiköissä. Kliinisen mikrobiologian laboratoriot hakevat toimilupaa aluehallintovirastolta. Niiden lakisääteisenä velvoitteena on yksittäisten tutkimusten tekeminen, mutta myös tartuntatautien seurantaan ja torjuntaan liittyvä löydösten ilmoittaminen sekä epidemiaan ja uusiin uhkiin varautuminen.
Vieritestausta voidaan tehdä vain sellaisissa toimintayksiköissä, joilla on kirjallinen valvontasopimus laajan laboratoriotoiminnan luvan saaneen kliinisen mikrobiologian laboratorion kanssa. Tällöin toimintayksikkö laatii omavalvontasuunnitelman, joka toimii palvelujen laadun ja kehittämisen päivittäisenä työvälineenä.
Valvova laboratorio on kliinisen mikrobiologian laboratorio, jolla on riittävä asiantuntemus ja resurssit valvontatoimintaan. Se opastaa ja avustaa kliinisen mikrobiologian tutkimusten ja menetelmien valinnassa, laadunvarmistuksen järjestämisessä sekä löydösten varmistuksen ja jatkotutkimusten suunnittelussa. Se myös tekee säännöllisiä käyntejä toimintayksikköön. Valvonta on vastikkeellista toimintaa.
Lopuksi
Molekyylibiologiset menetelmät ovat käytännössä lähes korvanneet viime vuosina virusviljelyn paremman herkkyyden ja diagnostiikan nopeuden vuoksi. Antigeeninosoitustestit ovat etenkin vieritestauksen käytössä helppoutensa ja nopeutensa vuoksi, mutta niiden herkkyys on heikompi kuin nukleiinihaponosoitustestien.
Kliinisen mikrobiologian nukleiinihappoanalytiikka vaatii syvää asiantuntemusta niin testien käyttöönoton yhteydessä kuin niiden käytön seurannassa ja ongelmatilanteiden selvittelyssä. Testi- ja laitealustojen valinta, tilojen ja prosessin suunnittelu, henkilökunnan perehdytys sekä testin huolellinen validointi ennen käyttöönottoa on tarpeen. Oman haasteensa tuo virusten geneettinen muuntelevuus, joka tulee huomioida ja luoda menettelyt PCR-testien toimivuuden seuraamiseen ja varmistamiseen myös muuntuneilla viruskannoilla (esim. influenssavirukset ja enterovirukset).
Vaikka nukleiinihaponosoitustesti on teknisesti hyvin luotettava, hengitystienäytteeseen ei aina saada tutkittavan mikrobin nukleiinihappoa, osin näytteenottotekniikan vuoksi, osin siksi, että näytteenoton ajoitus ei ole oikea suhteessa meneillään olevaan infektioon. Myös potilaan taudinkuvalla on merkitystä: mikäli oireet painottuvat alahengitysteihin, ylähengitysteistä otettu näyte ei ole välttämättä edustava. Näistä syistä diagnoosin varmistamiseksi voi olla tarpeen ottaa useampia hengitystienäytteitä, jos sairaalahoitoa tarvitsevalla potilaalla epäillään vahvasti COVID-19-tautia. Virusten aiheuttamien hengitystieinfektioiden diagnostiikassa vasta-ainemäärityksellä ei juuri ole roolia, mutta koronavirusinfektioksi epäillyn pitkittyneen taudin selvittelyssä se voi olla hyödyllinen.
Menetelmät kehittyvät ja vaatimukset diagnostisille testeille kasvavat jatkuvasti, kuten käynnissä oleva koronapandemiakin on osoittanut. Uusien teknologioiden kehitystä tulee jatkuvasti seurata ja analysoida. Tällä hetkellä selvitetään mm. sylkinäytteen ja tutkittavan itse ottamien näytteiden soveltuvuutta koronavirusdiagnostiikkaan sekä puhallustestien ja koronakoirien suorituskykyä. Ensimmäiset kotona tehtävät testit ovat myös saapumassa kuluttajien käyttöön. Mikäli uusien teknologioiden suorituskyky osoittautuu luotettavaksi, automatisoitavaksi ja suurillekin tutkimusmäärille soveltuvaksi, avautuu uusia mahdollisuuksia monien muidenkin infektiotautien diagnostiikkaan.
Raisa Loginov: Konsultointipalkkio (Labquality).
Maija Lappalainen: Luento- ja konsultointipalkkiot (Labquality).
- 1
- Ambert-Balay K, Pothier P. Evaluation of 4 immunochromatographic tests for rapid detection of norovirus in faecal samples. J Clin Virol 2013;56:194–8.
- 2
- Battaglioli G, Nazarian E, Lamson L ym. Evaluation of the RIDAQuick norovirus immunochromatographic test kit. J Clin Virol 2012;53:262–4.
- 3
- Kirby K, Gurgel R, Dove W ym. An evaluation of the RIDASCREEN and IDEIA enzyme immunoassays and the RIDAQUICK immunochromatographic test for the detection of norovirus in faecal specimens. J Clin Virol 2010;49:254–7.
- 4
- Leesa D. Bruggin K, Catton M, Marshall J. Evaluation of the Bioline Standard Diagnostics SD Immunochromatographic norovirus detection kit using fecal specimens from Australian gastroenteritis incidents. Diagn Microbiol Infect Dis 2013;76:147–52.
- 5
- Merckx J, Wali R, Schiller I ym. Diagnostic accuracy of novel and traditional rapid tests for influenza infection compared with reverse transcriptase polymerase chain reaction. a systematic review and meta-analysis. Ann Intern Med 2017;167:394–409.
- 6
- Fenollar F, Bouam A, Ballouche M ym. Evaluation of the Panbio Covid-19 rapid antigen detection test device for the screening on patients with Covid-19. J Clin Microbiol, verkossa ensin 2.11.2020. doi:10.1128/JCM.02589-20.
- 7
- Tansarli G, Chapin K. Diagnostic test accuracy of the Biofire® Filmarray® meningitis / encephalitis panel: a systematic review and meta-analysis. Clin Microbiol Infect 2020;26:281–90.
- 8
- Pfefferle S, Christner M, Aepfelbacher M ym. Implementation of the FilmArray ME panel in laboratory routine using a simple sample selection strategy for diagnosis of meningitis and encephalitis. BMC Infect Dis 2020;20:170.
- 9
- Corman V, Landt O, Kaiser M ym. Detection of 2019 novel coronavirus (2019-nCoV) by real-time RT-PCR. Euro Surveill 2020;25(3):2000045.
- 10
- Banerjee D, Kanwar N, Hassan F ym. Comparison of six sample-to-answer influenza A/B and respiratory syncytial virus nucleic acid amplification assays using respiratory specimens from children. J Clin Microbiol 2018;56(11):e00930-18.
- 11
- Jokela P, Jääskeläinen AE, Jarva H ym. SARS-CoV-2 sample-to-answer nucleic acid testing in a tertiary care emergency department: evalution and utility. J Clin Virol 2020;131:104614.
- 12
- Fournier P-E, Zandotti C, Ninove L ym. Contribution of VitaPCR SARS-CoV-2 to the emergency diagnosis of COVID-19. J Clin Virol 2020;133:104682.
- 13
- Gonzales M, Langley C, Buchan B et al. Multicenter evaluation of the Xpert norovirus assay for detection of norovirus genogroups I and II in fecal specimens. J Clin Microbiol 2016;54:142–7.
- 14
- McHugh M, Guerendiain D, Hardie A ym. Detection of norovirus by BD MAX, Xpert®Norovirus, and xTAG® Gastrointestinal Pathogen Panel in stool and vomit samples. J Clin Virol 2018;105:72–6.
- 15
- Alejo-Cancho I, Aviles F, Capon A ym. Evaluation of a multiplex panel for the diagnosis of acute infectious diarrhea in immunocompromised hematologic patients. PLoS One 2017;12(11):e0187458.
- 16
- Mifflin T. Setting up a PCR laboratory. Cold Spring Harbor Protocols 2007. doi:10.1101/pdb.top14. www.cshprotocols.cshlp.org
- 17
- Tartuntatautilaki 1227/2016. www.finlex.fi
Viral diagnostic methods: culture, antigen or nucleic acid detection?
Molecular biology techniques have come to play an increasingly important role in clinical virology laboratories during the last decades due to their superior sensitivity. In comparison to viral culture, nucleic acid tests are also considerably faster.
Viral disease diagnosis has traditionally relied on the isolation of viral pathogens in cell cultures. Although slow and cumbersome, the method has been regarded for decades as the gold standard for the laboratory diagnosis of viral disease. The advantage is that viral culture is able to differentiate between viable and nonviable virus.
Antigen detection methods detect viral antigens in patient samples by using specific mono- or polyclonal antibodies. Typically, antigen detection tests are fairly simple to perform and rapid, but their performance varies.
Nucleic acid detection tests are very sensitive and specific. In addition, they can detect viruses that cannot be grown in cell cultures. Although nucleic acid tests are rapid (as compared to viral culture), they require dedicated facilities, careful procedures and capable personnel. Quantitative versions of nucleic acid tests enable quantification of the viral load in the sample. Multiplex assays are suitable for syndromic testing, i.e. testing where the whole process uses one test to simultaneously target multiple pathogens with overlapping signs and symptoms. Nucleic acid tests are prone to contamination. To prevent contamination, it is essential to adopt best laboratory practices when performing nucleic acid tests, and to introduce and enforce proper laboratory or institution-wide procedures.
Laboratory investigations and tasks required to diagnose communicable diseases are carried out by laboratories that have been issued an operating license for said purpose and units under their supervision.
Technological development will advance further and the expectations towards the performance of diagnostic methods will increase. At present the suitability of saliva samples, the performance of breath tests, and the use of corona dogs are being studied for coronavirus diagnostics. If the performance of new technologies proves to be reliable and they can be automated and are suitable for high-throughput screening, this will open up new possibilities for the diagnosis of many other infectious diseases.