Vaikean astman biologiset lääkkeet: milloin käytän, miten valitsen
• Tyypin 2 tulehdukseen liittyvän vaikean allergisen eosinofiilisen astman ja ei-allergisen eosinofiilisen astman hoitoon sekä eosinofiliasta riippumattoman vaikean astman hoitoon on kehitetty tulehduksen välittäjäaineiden estäviä biologisia lääkkeitä.
• Biologisen lääkityksen aloittaminen vaikeaan astmaan edellyttää tulehdustyypin määrittämistä.
• Biologisilla lääkehoidoilla voidaan ennen kaikkea vähentää astman pahenemisvaiheita ja suun kautta otettavan glukokortikoidin tarvetta sekä glukokortikoidien runsaan käytön haittoja.

Astman keskeinen piirre on keuhkoputkien sileälihaksen supistumisesta johtuva vaihteleva ja usein lääkityksellä laukeava keuhkoputkien ahtautuminen. Tähän liittyy yleensä myös keuhkoputkien limakalvon tulehdus, jonka tyyppi ja voimakkuus vaihtelevat potilaittain (1). Tämän perusteella astma jaetaan erilaisiin tulehduksellisiin alatyyppeihin.
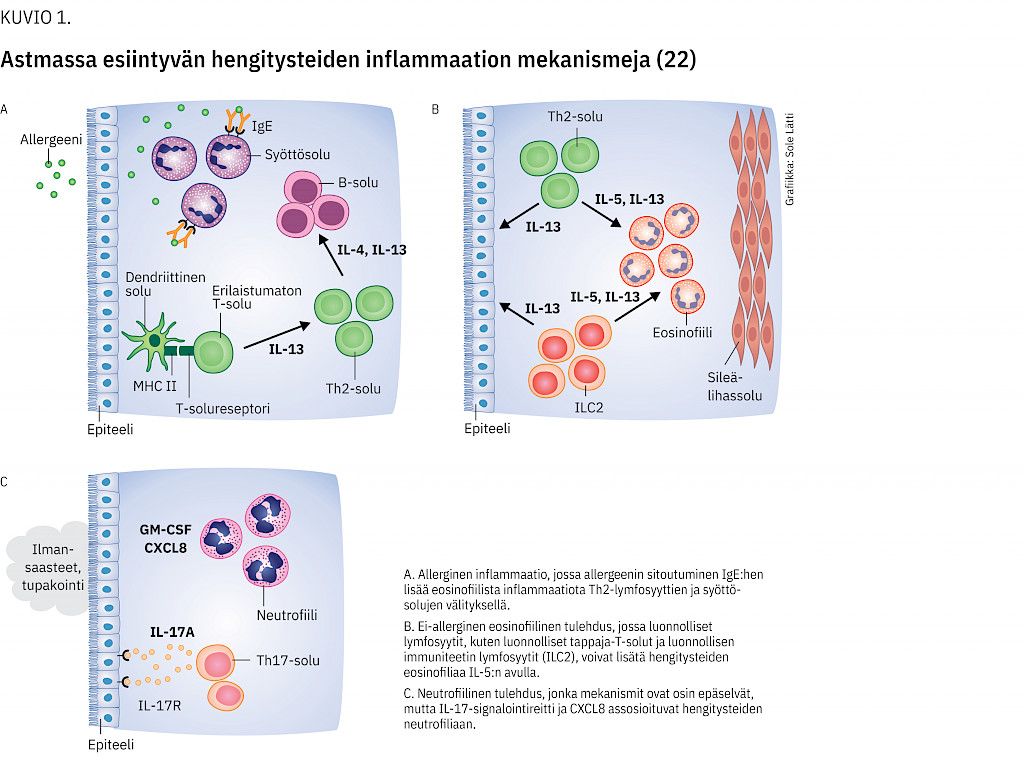
Astman tulehdukselliset alatyypit eroavat toisistaan yleisyyden, tyypillisen alkamisiän, vaikeusasteen ja liitännäissairauksien osalta (2,3) (kuvio 1). Kaikki nykyiset biologiset lääkehoidot on suunnattu tiettyyn tulehdusmekanismiin, ja siksi alatyypin määrittämisen tärkeys korostuu vaikean astman hoidossa.
Tulehdukselliset alatyypit
Immuunipuolustuksen perusreaktioissa puhutaan tyypin 1, 2 ja 3 tulehdusreaktioista, jotka suuntautuvat normaalisti solunsisäisiä patogeeneja (tyyppi 1), solunulkoisia loisia (tyyppi 2) tai solunulkoisia bakteereja ja sieniä (tyyppi 3) vastaan (4).
Osaan astmasta liittyy tyypin 2 tulehdus, jolle tunnusomaisia piirteitä ovat IL-5-tuotantoon liittyen eosinofiilinen limakalvotulehdus hengitysteissä ja veren eosinofiilisten solujen suurentunut määrä (yli 0,3 × 109 solua/l eli 300 solua / µl), suurentunut uloshengitysilman typpioksidipitoisuus (FeNO yli 50 ppb hoitamattomassa astmassa tai yli 25 ppb hoidetussa astmassa) (1).
Parhaiten tunnettu ja eniten tutkittu astman tulehduksellinen alatyyppi on T2-tulehdukseen liittyvä allerginen astma, jossa IgE-välitteinen allergia aiheuttaa eosinofiilisen limakalvotulehduksen (2). Allerginen astma alkaa yleensä lapsena tai nuorena aikuisena, harvoin enää myöhemmällä aikuisiällä. Siihen liittyy usein allerginen nuha ja atooppinen ihottuma. Vaste hengitettävään kortikosteroidiin on yleensä hyvä (5).
Toinen T2-tulehdukseen liittyvä astman alatyyppi on ei-allerginen eosinofiilinen astma (2). Se alkaa pääosin vasta aikuisiässä ja on allergista astmaa useammin vaikea. Siihen liittyy tavallisesti krooninen sinuiitti (polyypeilla tai ilman) ja joskus tulehduskipulääkeintoleranssi.
Osalla astmapotilaista ei ole eosinofiilista limakalvotulehdusta vaan heillä voi olla huonosti tunnettu neutrofiilinen astmatulehdus tai ns. vähägranulosyyttinen astma (3,6). Näiden T2-tulehdukseen liittymättömien alatyyppien yleisyys ja syntymekanismit tunnetaan huonosti. Ainakin tupakoinnilla sekä muilla pitkäaikaisilla hengitysteitä ärsyttävillä altisteilla ajatellaan olevan osuutensa (kuvio 1).
Tulehduksellisen alatyypin selvittely voi edellyttää ennen lääkityksen aloittamista tehtyjen tutkimusten arviointia. Verieosinofilia korreloi hengitysteiden eosinofiiliseen tulehdukseen, mutta sen puuttuminen ei täysin sulje pois hengitysteiden eosinofilian mahdollisuutta.
Vaikeahoitoinen ja vaikea astma
Vaikeahoitoisella astmalla tarkoitetaan tilannetta, jossa potilaalle on asetettu astmadiagnoosi mutta oireilua ja pahenemisvaiheita ei ole saatu tavanomaisella lääkityksellä hallintaan. On tärkeää huomata, että taustalla on usein jokin muu syy kuin varsinainen vaikea astma. Sellainen voi olla mm. huono sitoutuminen hoitoon tai lääkkeenottotekniikka, hoitamattomat astmaa pahentavat liitännäissairaudet, nykyisten oireiden virheellinen tulkinta astmaksi tai muut astmaa pahentavat tekijät, kuten tupakointi tai altistuminen hengitysteitä ärsyttäville tekijöille tai muut hengenahdistusta aiheuttavat sairaudet (6).
Vaikeahoitoisessa astmassa tarvitaan aina perusasioiden systemaattinen arvio sekä perusterveydenhuollossa että erikoissairaanhoidossa. Astman systemaattinen arvio (kuvio 2) on kuvattu tarkemmin aiemmassa katsauksessamme (6,7).
{{embed-asset-69037}}
Astma voidaan todeta vaikeaksi, jos sen pitämiseksi hallinnassa potilas tarvitsee suuria annoksia hengitettävää kortisonia ja vähintään yhtä säännöllistä lisälääkettä tai astma ei ole näistä hoidoista huolimatta hallinnassa (8). Toistuvat pahenemisvaiheet inhalaatiolääkehoidosta huolimatta ovat vaikealle astmalle tyypillisiä.
Tämän määritelmän mukaista vaikeaa astmaa arvellaan sairastavan noin 5–10 % astmaatikoista (1). Heistä suurin osa ei kuitenkaan tarvitse astman biologisia hoitoja, vaan sairaus saadaan hallintaan tavallisilla astmalääkkeillä (hengitettävä kortisoni, pitkävaikutteinen beeta2-agonisti, pitkävaikutteinen antikolinergi ja leukotrieeninsalpaaja).
Biologiset lääkkeet
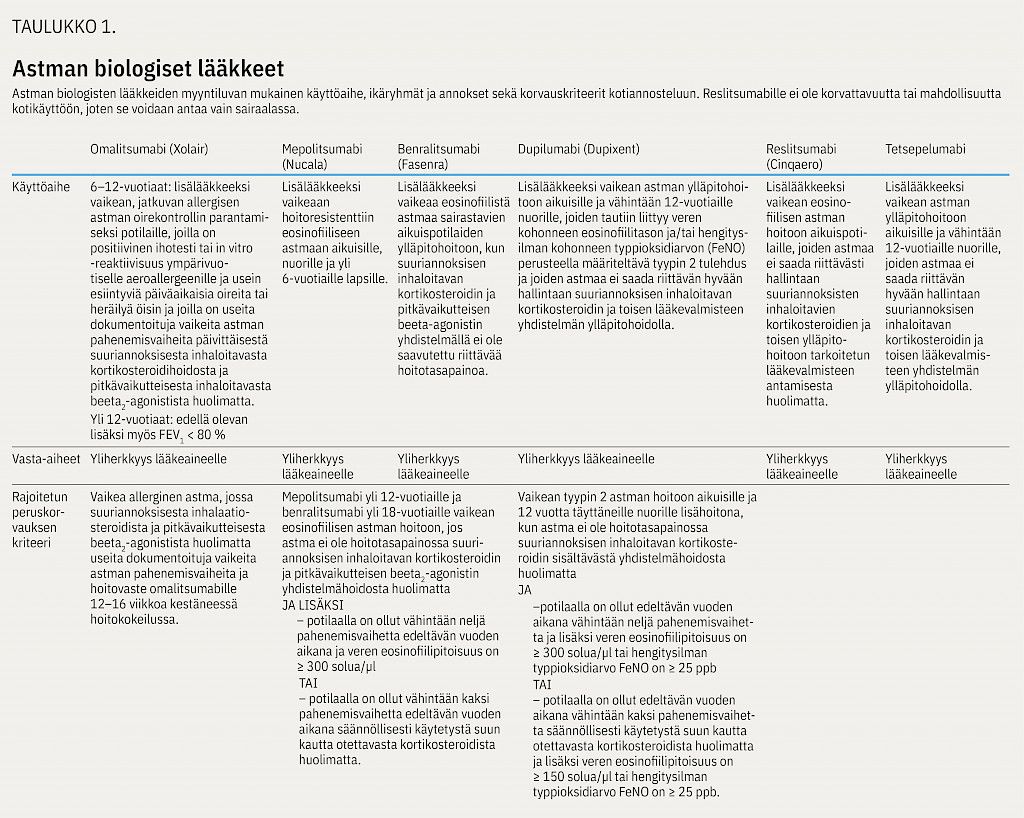
Nykyisin vaikean astman hoitoon on erikoissairaanhoidossa käytössä kuusi erilaista monoklonaalista vasta-ainetta. Ne on pääosin suunnattu T2-tulehdukseen liittyvään vaikeaan astmaan (allerginen tai eosinofiilinen astma). Viimeksi hyväksytyn lääkkeen tetsepelumabi käyttöaiheena on myös ei-eosinofiilinen vaikea astma.
Eosinofiilinen vaikea astma saadaan yleensä hyvään hallintaan säännöllisesti suun kautta otettavalla glukokortikoidilla, mutta sillä on pitkäaikaiskäytössä hankalia haittoja (9). Kaikkien nykyisten biologisten astmalääkkeiden tärkein vaikutus on mahdollisuus vähentää tai lopettaa säännöllisen systeemisen glukokortikoidin käyttö. Lisäksi astman pahenemisvaiheet sekä niihin tarvittavat lyhyet glukokortikoidikuurit vähenevät. Oireiden hallinta ja keuhkojen toiminta voivat myös parantua.
Kaikki nykyiset biologiset astmalääkkeet ovat varsin turvallisia. Haittoina voi esiintyä pistoskohdan ärsytystä tai päänsärkyä, mutta anafylaksia ja muut vakavat haitat ovat erittäin harvinaisia. Tähän mennessä kertyneen tiedon perusteella ei ole havaittu myöskään lisääntynyttä syöpien ilmaantumista, mutta maligniteettien ja kardiovaskulaaritapahtumien tilannetta seurataan (1,10).
IgE-vasta-aine
Omalitsumabi on monoklonaalinen IgG-vasta-aine, joka on suunnattu ihmisen omia IgE-vasta-aineita kohtaan. Se estää niitä sitoutumasta syöttösolun pintaan ja aktivoimasta allergista reaktiota (kuvio 1).
Omalitsumabi on tarkoitettu vaikean allergisen astman hoitoon potilaille, jotka ovat herkistyneet ympärivuotiselle allergeenille eivätkä saa suuriannoksisesta hengitettävästä kortisonista ja toisesta lääkkeestä huolimatta astmaa riittävään hallintaan, vaan heillä on toistuvia pahenemisvaiheita. Lääke tehoaa myös krooniseen urtikariaan (11) ja krooniseen polypoottiseen sinuiittiin (12), vaikka näissä taudeissa IgE-välitteisellä allergialla ei ehkä merkittävää roolia olekaan eikä se ole näissä taudeissa edellytys omalitsumabihoidolle.
IL-5- ja IL-5R-vasta-aineet
Mepolitsumabi ja reslitsumabi ovat monoklonaalisia IgG-vasta-aineita IL-5:tä kohtaan, ja ne estävät IL-5-molekyyliä sitoutumasta reseptoriinsa. Benralitsumabi taas on monoklonaalinen IgG-vasta-aine IL-5-reseptorin alfa-alayksikköä kohtaan, ja näin se estää IL-5:tä sitoutumasta reseptoriinsa (kuvio 2).
Kaikki nämä lääkeaineet estävät IL-5-signaalia ja vähentävät eosinofiilien syntymistä luuytimessä, niiden kypsymistä, aktivoitumista ja siirtymistä kohdekudokseen (13,14,15). Vielä ei tarkkaan tiedetä, onko eosinofiileilla merkitystä elimistön normaalin toiminnan, homeostaasin, kannalta (15).
Mepolitsumabi ja benralitsumabi tehoavat vaikean eosinofiilisen astman lisäksi krooniseen polypoottiseen sinuiittiin (12,16).
IL-4R-alfa-vasta-aine
Dupilumabi on monoklonaalinen vasta-aine IL-4-reseptorin alfa-alayksikköä kohtaan (kuvio 1). Tätä reseptorialayksikköä on sekä IL-13- että IL-4-viestiä välittävissä reseptoreissa ja näin dupilumabi estää T2-tulehduksessa sekä IL-4- että IL-13-toimintaa.
IgE-synteesin vähenemisen ja sileälihaksen aktiivisuuden vähenemisen lisäksi dupilumabi vähentää eosinofiileja kudoksiin houkuttelevan eotaksiinin synteesiä, mutta ei vaikuta suoraan eosinofiilien tuotantoon luuytimessä. Tähän liittyen veren eosinofiilimäärä yleensä suurenee ohimenevästi dupilumabihoidon alussa.
Dupilumabi tehoaa vaikean eosinofiilisen astman lisäksi hyvin myös vaikeaan atooppiseen ekseemaan (18) ja krooniseen polypoottiseen sinuiittiin (12).
TSLP-vasta-aine
Tetsepelumabi on TSLP-vasta-aine (kateenkorvan lymfopoietiinin vasta-aine), joka vähentää IL-5- ja IL-13-sytokiineja sekä eosinofiliaa, keuhkoputkien limakalvon eosinofiliaa, uloshengityksen typpioksidipitoisuutta ja siten astmassa vaikuttavaa inflammaatiota.
Kliininen teho havaitaan pahenemisvaiheiden vähenemisenä, ja se näyttää tapahtuvan, vaikka eosinofiilisen tulehduksen merkkiainepitoisuudet olisivat normaalit.
Lääkehoidon aloittaminen, hoitovasteen arvioiminen ja muun lääkityksen säätäminen
Biologisen lääkehoidon aloittamista harkittaessa tärkeintä on vaikeahoitoisen astman systemaattinen arvio, vaikean astman diagnoosin varmistaminen ja tavanomainen astman hoidon optimointi (6,7). Jos oireilun syyksi varmistuu vaikea astma ja hoidon optimoimisesta ja astman hallintaa heikentävien tekijöiden eliminoimisesta huolimatta potilaalla on toistuvia pahenemisvaiheita, voidaan biologisen lääkehoidon aloittamista harkita erikoissairaanhoidossa.
Biologista lääkettä harkittaessa määritetään astman tulehduksellinen alatyyppi. Lisäksi arvioidaan, onko potilaalla sellaisia liitännäissairauksia, joiden hoidossa biologisesta lääkkeestä olisi hyötyä.
Omalitsumabihoidon tehon kannalta on tärkeää varmistaa, että astma liittyy IgE-välitteiseen allergiaan. Vastetta IL-5:n estäjiin ennustaa parhaiten IL-5-tuotantoon liittyvä suurentunut veren eosinofiilimäärä. Dupilumabia käytettäessä hyvää vastetta ennustavat puolestaan sekä IL-13:en liittyvä suurentunut FeNO-arvo että myös suurentunut veren eosinofiilimäärä (1,10,17). Tetselumabista odotetaan vielä käyttökokemusta; hyöty on paras eosinofiilisessa astmassa, mutta sitä saadaan myös ilman aktiivista eosinofiilista tulehdusta (19).
Astman hoitoon tarkoitetuista biologisista lääkkeistä omalitsumabia, mepolitsumabia, benralitsumabia ja dupilumabia potilas voi pistää itse kotona ihonalaiskudokseen. Näiden lääkkeiden käyttöön Kela voi myöntää rajoitetun peruskorvattavuuden. Korvauskriteerit käytännössä ohjaavat lääkkeiden käyttöä, vaikka ne eivät sellaisenaan käy diagnostisiksi kriteereiksi eivätkä yksinomaan määritä lääkityksestä hyötyvää potilasryhmää (taulukkko 1). Reslitsumabi annetaan laskimoinfuusiona sairaalassa. ja sen käyttö onkin Suomessa varsin vähäistä.
Biologista lääkehoitoa aloitettaessa arvioidaan tulehdustyypin lisäksi myös oireiden hallinta, pahenemisvaiheiden määrä, systeemisen glukokortikoidin käyttö ja lääkehaitat. Näiden perusteella asetetaan tavoitteet biologiselle lääkehoidolle.
Vastetta arvioidaan esimerkiksi 3–6 kuukauden ja 12 kuukauden kuluttua hoidon aloituksesta. Kontrollikäynneillä määritetään oireiden hallinta, pahenemisvaiheiden esiintyminen ja systeemisen glukokortikoidin käyttötarve biologisen lääkkeen käytön aikana. Näiden perusteella arvioidaan, onko hoidolla saatu riittävä vaste ja onko sitä tarpeen jatkaa.
Jos potilaalla on säännöllinen systeeminen glukokortikoidi käytössä biologista lääkehoitoa aloitettaessa, keskeinen tavoite on sen annoksen pienentäminen tai lopettaminen. Usein etenkin IL-5:n estäjiä käytettäessä voidaan varsin nopeasti pienentää systeemisen glukokortikoidin annosta (20), mutta pienentämistä alle 5 mg:aa prednisolonia vastaavaan vuorokausiannokseen ei suositella, ennen kuin oma kortisolin tuotanto on tutkittu. Hypokortisolismia hoidetaan hydrokortisonikorvaushoidolla.
Lopuksi
Vaikka biologista lääkehoitoa tarvitsee onneksi vain pieni osa astmaa sairastavista, taudin yleisyyden vuoksi potilaiden lukumäärä on kuitenkin kohtalaisen suuri (tällä hetkellä noin 700 käyttäjää Suomessa). Joitakin kustannusvaikuttavuusarvioita astman biologisista lääkehoidoista on tehty (21), mutta laatupainotteisen elinvuoden hinta vaihtelee kovasti laskentamalleittain eikä minkään tähänastisen julkaisun laskentatapa kovin hyvin sovellu suomalaiseen hoitokäytäntöön.
Oma arviomme käytännön perusteella on, että huolellisesti harkiten käytettyinä biologiset lääkkeet ovat hyvä lisä astman hoitovalikoimaan.
Perusterveydenhuollossa ja työterveyshuollossa ensisijaisia ovat luotettava astmadiagnostiikka, tavanomainen astman hoito ja niiden potilaiden ohjaaminen erikoissairaanhoitoon, joilla on huono astman hallinta tai toistuvia pahenemisvaiheita näistä toimista huolimatta. Erikoissairaanhoidon tehtäviä ovat vaikeahoitoisen ja vaikean astman erottaminen luotettavasti toisistaan, astman hoidon optimoiminen, vaikean astman tulehduksellisen alatyypin määrittäminen ja tarvittaessa biologisen lääkehoidon aloittaminen.
Lauri Lehtimäki: Konsultointipalkkiot, luentopalkkiot, korvaus koulutusaineiston tuottamisesta (Astra Zeneca, Boehringer Ingelheim, GSK, Novartis, Orion, Sanofi), asiantuntijalausunto (Astra Zeneca), matka-, majoitus- tai kokouskulut (Sanofi).
Jussi Karjalainen: Konsultointipalkkiot (Astra Zeneca, GSK, MSD, Sanofi), työsuhde (SUEK), asiantuntijalausunto (Tampereen Tuberkuloosisäätiö), luentopalkkiot (Astra Zeneca, Boehringer Ingelheim, Chiesi, GSK, Novartis, Orion).
Emma Genberg: Apurahoja väitöskirjaprojektiin yhdistyksiltä ja säätiöiltä, kongressimatka (Orion Pharma).
Maritta Kilpeläinen: Konsultointipalkkiot (Astra Zeneca, Boehringer Ingelheim, GSK), luentopalkkiot (Alk-Abello, Astra Zeneca, Boehringer-Ingelheim, Chiesi, GSK), useiden vaikean astman kliinisten lääketutkimusten päätutkijana Tyksissa.
Paula Kauppi: Konsultointipalkkkiot (Sanofi, Sobi), Allergiset sairaudet ja astma -kirjan toimittaja (Kustannus Oy Duodecim).
- 1
- Global Initiative for Asthma (GINA). Global strategy for asthma management and prevention 2021. www.ginasthma.org.
- 2
- Wenzel SE. Asthma phenotypes: the evolution from clinical to molecular approaches. Nat Med 2012;18(5):716–25.
- 3
- Erjefält JS. Unravelling the complexity of tissue inflammation in uncontrolled and severe asthma. Curr Opin Pulm Med 2019;25(1):79–86.
- 4
- Egholm C, Heeb LEM, Impellizzieri D, Boyman O. The regulatory effects of interleukin-4 receptor signaling on neutrophils in type 2 immune responses. Front Immunol 2019;10:2507.
- 5
- Pakkasela J, Ilmarinen P, Honkamäki J ym. Age-specific incidence of allergic and non-allergic asthma. BMC Pulm Med 2020;20(1):9. doi: 10.1186/s12890-019-1040-2
- 6
- Lehtimäki L, Karjalainen J. Erikoissairaanhoidon rooli astman diagnostiikassa ja hoidossa. Duodecim 2019;138(18):1779–86.
- 7
- Porsbjerg C, Ulrik C, Skjöld T ym. Nordic consensus statement on the systematic assessment and management of possible severe asthma in adults. Eur Clin Respir J 2018;5(1):1440868.
- 8
- Chung KF, Wenzel SE, Brozek JL ym. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur Respir J 2014;43(2):343–73.
- 9
- Price DB, Trudo F, Voorham J ym. Adverse outcomes from initiation of systemic corticosteroids for asthma: long-term observational study. J Asthma Allergy 2018;11:193–204.
- 10
- Agache I, Beltran J, Akdis C ym. Efficacy and safety of treatment with biologicals (benralizumab, dupilumab, mepolizumab, omalizumab and reslizumab) for severe eosinophilic asthma. A systematic review for the EAACI Guidelines - recommendations on the use of biologicals in severe asthma. Allergy 2020;75(5):1023–42.
- 11
- Wedi B, Traidl S. Anti-IgE for the treatment of chronic urticaria. Immunotargets Ther 2021;10:27–45.
- 12
- Hellings PW, Verhoeven E, Fokkens WJ. State-of-the-art overview on biological treatment for CRSwNP. Rhinology 2021;59(2):151–63.
- 13
- Kolbeck R, Kozhich A, Koike M ym. MEDI-563, a humanized anti-IL-5 receptor alpha mAb with enhanced antibody-dependent cell-mediated cytotoxicity function. J Allergy Clin Immunol 2010;125(6):1344–53.e2.
- 14
- Moran AM, Ramakrishnan S, Borg CA ym. Blood eosinophil depletion with mepolizumab, benralizumab, and prednisolone in eosinophilic asthma. Am J Respir Crit Care Med 2020;202(9):1314–6.
- 15
- Kanda A, Yun Y, Bui DV ym. The multiple functions and subpopulations of eosinophils in tissues under steady-state and pathological conditions. Allergol Int 2021;70(1):9–18.
- 16
- Harrison TW, Chanez P, Menzella F ym. Onset of effect and impact on health-related quality of life, exacerbation rate, lung function, and nasal polyposis symptoms for patients with severe eosinophilic asthma treated with benralizumab (ANDHI): a randomised, controlled, phase 3b trial. Lancet Respir Med 2021;9(3):260–74.
- 17
- Castro M, Corren J, Pavord ID ym. Dupilumab efficacy and safety in moderate-to-severe uncontrolled asthma. N Engl J Med 2018;378(26):2486–96.
- 18
- Thibodeaux Q, Smith MP, Ly K, Beck K, Liao W, Bhutani T. A review of dupilumab in the treatment of atopic diseases. Hum Vaccin Immunother 2019;15(9):2129–39.
- 19
- Menzies-Gow A, Corren J, Bourdin A ym. Tezepelumab in adults and adolescents with severe, uncontrolled asthma. N Engl J Med 2021;384(19):1800–9.
- 20
- Menzies-Gow A, Corren J, Bel EH ym. Corticosteroid tapering with benralizumab treatment for eosinophilic asthma: PONENTE Trial. ERJ Open Res 2019;5(3):00009-2019. doi: 10.1183/23120541.00009-2019
- 21
- Anderson WC,3rd, Szefler SJ. Cost-effectiveness and comparative effectiveness of biologic therapy for asthma: To biologic or not to biologic? Ann Allergy Asthma Immunol 2019;122(4):367–72.
Biological treatment in severe asthma – indications and selection of the appropriate drug
Asthma is divided into different endotypes based on the underlying inflammatory mechanisms. Allergic eosinophilic asthma and non-allergic eosinophilic asthma are driven by type 2 (T2) inflammation mediated by interleukins 4, 5 and 13, and TSLP. About 5 to 10% of patients with asthma suffer from severe disease, and some of them cannot achieve sufficient disease control with conventional medication. In cases of difficult-to-treat asthma, systematic assessment is needed to ensure that current symptoms are associated with asthma, to check adherence to maintenance medication and correct inhaler technique, and to treat possible comorbidities and aggravating factors.
Biological medications to control T2 inflammation have been introduced for the treatment of severe asthma. These include monoclonal antibodies against IgE (omalizumab), IL-5 (mepolizumab and reslizumab), the IL-5 receptor (benralizumab), the IL-4/13 receptor (dupilumab) and TSLP (tezepelumab). Before initiation of biological treatment, systematic assessment of the asthma and its inflammatory phenotype is necessary. An increased blood eosinophil count (> 300 cells/µl) predicts a favourable response to anti-IL-5, anti-IL-5R and anti-IL-4R treatment, while an increased exhaled nitric oxide concentration predicts response to anti-IL-4R treatment. Anti-IgE treatment can be used in subjects with severe allergic asthma and sensitization to perennial allergens.
The most important effect of biological treatment in asthma is reduction of asthma exacerbations and a reduced need for maintenance oral corticosteroids or bursts of oral corticosteroids. In some patients, treatment of severe asthma with biological medications may also improve symptom control and lung function.
Lauri Lehtimäki, Jussi Karjalainen, Emma Genberg, Maritta Kilpeläinen, Paula Kauppi
Lauri Lehtimäki
Professor, Senior Lecturer
University of Tampere and Allergy Center, Tampere University Hospital