Tyypin 2 diabeteksen insuliinihoito
• Tyypin 2 diabetes on ilmiasultaan monimuotoinen metabolinen sairaus, jossa insuliiniresistenssi ja häiriöt insuliininerityksessä johtavat hyperglykemiaan.
• Jos potilaalla on oireinen hyperglykemia hoidon alussa, insuliinihoito voi olla tarpeen ohimenevästi.
• Insuliinihoito on aiheen niillä tyypin 2 diabetespotilailla, joilla on insuliinin puute.
• Tilapäisesti insuliinihoitoa voidaan tarvita tulehdussairauden, kortisonihoidon tai leikkauksen yhteydessä.
• Pitkäkestoisessa taudissa insuliinineritys heikkenee osalla tyypin 2 diabeetikoista niin, että tarvittaessa siirrytään insuliinihoitoon.

Tyypin 2 diabeteksessa insuliiniresistenssi ja häiriöt insuliininerityksessä johtavat hyperglykemiaan. Noin 75 %:lla diabeetikoista on tyypin 2 diabetes (1).
Käsitys tyypin 2 diabeteksen monimuotoisuudesta on tarkentunut. Sen eri alalajeja voidaan kliinisesti arvioida määrittämällä plasman glukoosin lisäksi C-peptidi, glutamaattidekarboksylaasi (GAD) -vasta-aineet ja painoindeksi sekä huomioimalla sairastumisikä (2).
Osalla potilaista on insuliininpuutos jo diagnoosivaiheessa, ja silloin hoito on insuliinikorvaushoito (2,3). Tämä alaryhmä tunnistetaan liian harvoin (2). Valtaosa tyypin 2 potilaista on ylipainoisia tai lihavia, ja hoidon kivijalkana ovat elämäntapamuutokset, jotka tähtäävät painon vähenemiseen (1,4). Painon pudotuksella alle 6 vuotta kestänyt tyypin 2 diabetes on mahdollista jopa saada remissioon (5).
Metformiini lisätään tyypin 2 diabeteksen hoitoon jo alkuvaiheessa, ellei sille ole vasta-aiheita (1,6). Uusina lääkeryhminä hoitoon ovat tulleet glukagoninkaltaisen peptidi 1:n (glucagon like peptide-1 (GLP1)) reseptoriagonistit sekä munuaisissa glukoosin reabsorptiota estävät natriumin- ja glukoosinkuljettajaproteiini 2:n (SGLT2) estäjät. Uudet lääkkeet parantavat ennustetta.
GLP1-reseptoriagonistin tai SGLT2-estäjän lisäämistä voidaan harkita vaihtoehtoisena tai metformiinin rinnalle jo hoidon alkuvaiheessa HbA1c-pitoisuudesta riippumatta (7), etenkin jos potilaalla on suuri kardiovaskulaari- tai munuaissairauden riski. Jos potilaalla on merkittäviä oireita aiheuttava hyperglykemia diagnoosivaiheessa, voidaan harkita usean oraalisen diabeteslääkkeen ja GLP1-reseptoriagonistin yhdistämistä tai perusinsuliinihoidon aloittamista.
Alkuvaiheen insuliinihoito päästään usein purkamaan, kun glukoosikontrolli paranee. Nykykäsityksen mukaan tyypin 2 diabetes on etenevä sairaus. Pitkäkestoisessa taudissa insuliinineritys heikkenee osalla potilaista niin, että tarvittaessa siirrytään insuliinihoitoon.
Tuore tyypin 2 diabetes ja insuliinihoito
Tyypin 2 diabeteksen alkuhoito aloitetaan yleensä korjaamalla ruokavaliota, lisäämällä liikuntaa ja pudottamalla painoa. Elämäntapamuutoksiin yhdistetään tarvittaessa metformiini jo hoidon alkuvaiheessa (1,6). Insuliinihoito on perusteltua aloittaa jo alkuvaiheessa, jos potilaalla on diagnoosihetkellä oireinen hyperglykemia (glukoosi yli 16,7 mmol/l, HbA1c yli 10 % (86 mmol/mol), erityisesti jos siihen liittyy painon lasku (6,8). Nämä oireet viittaavat kataboliseen tilaan. Tällöin tulee muistaa kehittyvän ketoasidoosin mahdollisuus ja mitata plasman ketoaineet (1).
Metabolinen kontrolli paranee insuliinihoidon ansiosta nopeasti, ja elämätapamuutosten sekä mahdollisen muun lääkehoidon vuoksi insuliinihoidosta voidaan yleensä luopua (8). Hyperglykeemisten potilaiden lyhytkestoinen (2–5 viikkoa) intensiivinen insuliinihoito alkuvaiheessa parantaa endogeenistä insuliinineritystä. Osalla potilaista se voi johtaa yli vuoden kestävään remissioon (9,10).
Milloin insuliinia vakiintuneessa tyypin 2 diabeteksessa?
Jos hoitotavoitteita ei saavuteta elämäntapamuutoksilla ja metformiinilla, hoitoon voidaan kombinoida muita tablettimuotoisia diabeteslääkkeitä tai harkita pistettäviä valmisteita, eli GLP-1-reseptoriagonisteja tai insuliinia. Lisäksi saatavilla on suun kautta annosteltava GLP-1-reseptoriagonisti semaglutidi.
Jos potilaalla ei ole viitteitä insuliinin puutteesta, pistettävän GLP-1-reseptoriagonistin yhdistäminen hoitoon on suositeltavampaa kuin insuliinihoidon aloittaminen, sillä ylipainoisen potilaan paino yleensä putoaa GLP-1-reseptoriagonistin aloittamisen jälkeen, ja glukoosikontrolli paranee (6).
Hoidon tehostaminen insuliinilla tulee kyseeseen, jos potilaalla on merkittävästi oireinen hyperglykemia. Väliaikaiselle insuliinihoidolle voi olla tarvetta myös insuliiniresistenssiä tilapäisesti lisäävissä tiloissa. Tällaisia ovat vaikeat tulehdukset tai muut akuutit sairaudet, kortisonihoito ja kirurgiset toimenpiteet (1,11).
Jos potilaalle ilmaantuu kliinisiä viitteitä insuliinin puutteesta (oireinen hyperglykemia, polyuria, polydipsia ja spontaani painonlasku), insuliinihoito kannattaa aloittaa. Potilaan omaa insuliinineritystä voidaan arvioida mittaamalla C-peptidi ja määrittämällä samaan aikaan plasman glukoosipitoisuus. Glukoosipitoisuuden tulisi olla vähintään 7 mmol/l. Käytännössä tämä voidaan toteuttaa mittaamalla plasman glukoosi ja C-peptidi esimerkiksi 2 tunnin kuluttua runsaasta hiilihydraattipitoisesta ateriasta. Jos C-peptidi on hyperglykeemisellä potilaalla alle 0,3 nmol/l, potilaalla on käytännössä insuliininpuute ja hän tarvitsee insuliinikorvaushoidon ketoasidoosiriskin vuoksi (1).
Insuliinihoitoa aloittaessa kannattaa korostaa, että insuliinihoito ei suinkaan merkitse potilaan epäonnistumista hoidossaan (6,8). Osalla tyypin 2 diabetespotilaista oma insuliinineritys hiipuu ajan mittaan. Tällöin insuliinihoidossa on kyse puuttuvan hormonin korvaushoidosta. Paremmalla metabolisella kontrollilla tähdätään diabeteksen komplikaatioiden estoon ja oireettomuuteen (1).
Insuliinihoidon toteuttaminen
Tyypin 2 diabeteksessa insuliinihoito voidaan yhdistää osaksi muuta hoitoa. Se voidaan toteuttaa perusinsuliinihoidolla, ateriainsuliinihoidolla, monipistoshoidolla, sekoiteinsuliinihoidolla tai insuliinipumppuhoidolla (1).
Yleisesti glukoosipitoisuuden tavoitteena on paastossa alle 7 mmol/l ja noin 2 tuntia ateriasta alle 10 mmol/l (1). Insuliinihoitoisen diabeetikon HbA1c-lukeman tavoite on yleensä alle 7 % (53 mmol/mol), ilman vakavia hypoglykemioita (8,12).
Tavoitetaso voi olla kuitenkin yksilöllisesti tiukempi tai väljempi, ja se kirjataan perusteluineen potilaan hoitosuunnitelmaan. Esimerkiksi monisairaalla ikääntyneellä voidaan hyväksyä suurempikin HbA1c-pitoisuus, kunhan potilaalla ei esiinny oireista hyperglykemiaa. HbA1c-arvon ei kuitenkaan tulisi olla yli 70 mmol/mol (8,5 %), jos potilaalla on jäljellä edes jonkin verran elinvuosiennustetta (12).
Perusinsuliinihoito
Tyypin 2 diabeteksen insuliinihoito aloitetaan yleensä perusinsuliinilla. Perusinsuliinilla tarkoitetaan pidempivaikutteista insuliinia, jolla katetaan perusmetabolian tarve. Sen vaikutus kohdistuu erityisesti maksan glukoosintuoton säätelyyn (4).
Monille tyypin 2 diabetespotilaille perusinsuliini riittää osaksi muuta hoitoa, sillä parantunut glukoositasapaino vähentää beetasoluihin kohdistuvaa suuren glukoosipitoisuuden aiheuttamaa glukotoksisiteettia. Tällöin oman insuliininerityksen virkistyminen usein kattaa aterian sisältämät hiilihydraatit.
Perusinsuliiniin voidaan elämäntaparemontin lisäksi yhdistää oraalisia lääkeitä tai GLP-1-reseptoriagonisti (1). Jos potilas ei ole käyttänyt insuliinihoitoa aiemmin, perusinsuliinihoidon etuna on sen yksinkertaisuus. Satunnaistetussa tutkimuksessa verrattiin perusinsuliini glargiinia kertapistoksena ateriainsuliini lisproon kolmesti päivässä annosteltuna potilailla, joiden glukoosikontrolli ei ollut tavoitteen mukainen suun kautta otettavilla diabeteslääkkeillä. Kumpikin insuliinihoito paransi HbA1c:ta samankaltaisesti. Potilastyytyväisyys oli kuitenkin suurempi perusinsuliiniryhmässä, jossa esiintyi myös vähemmän hypoglykemioita (13).
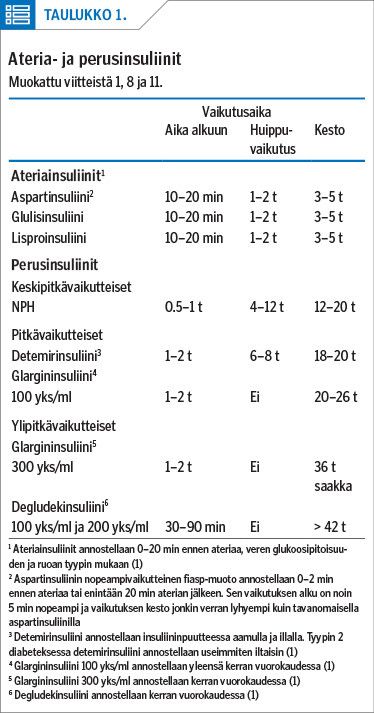
Perusinsuliinina voidaan käyttää keskipitkävaikutteista NPH (Neutral Protamin Hagedorn) -insuliinia, pitkävaikutteisia insuliinianalogeja glargininsuliini 100 yks/ml tai detemirinsuliinia, tai ultrapitkävaikutteista glargininsuliinia 300 yks/ml tai degludekinsuliinia (1,8,11,14).
Eri insuliinivalmisteiden vaikutuksessa glukoositasapainoon ei ole merkittävästi eroa (14,15,16). Detemirinsuliinin tai glargininsuliinin 100 yks/ml käyttöön liittyy kuitenkin NPH-insuliiniin verrattuna vähemmän yöllistä hypoglykemiaa. Glargininsuliinilla 300 yks/ml ja degludekinsuliinilla on glargininsuliiniin 100 yks/ml verrattuna pienempi hypoglykemiariski ja vähemmän yöllisiä hypoglykemioita (14).
Perusinsuliinin vaikutus kohdentuu maksan glukoosintuotannon hillitsemiseen, ja hoidossa tavoitellaan lähes normaalia aamun paastoglukoosipitoisuutta (1,11). Sopiva aloitusannos voi olla esimerkiksi 10 yksikköä (tai 0,2 yksikköä / kg) illalla ennen nukkumaanmenoa. Insuliinin annosta suurennetaan tarvittaessa muutama kerta viikossa paastoglukoosin perusteella. Tavoitteena on paastoglukoosipitoisuus 5–7 mmol/l (1).
Verenglukoosin ilta-aamumittaukset kannattaa tehdä säännöllisesti esimerkiksi kerran viikossa, jottei perusinsuliinin annos suurene tarpeettoman paljon. Liian suureen perusinsuliiniannokseen viittaavat insuliiniannos yli 0,5 yksikköä/kg, painonnousu, herkästi ilmaantuvat hypoglykemiat, tarve tankata hiilihydraatteja illalla ja glukoosipitoisuuden pieneneminen ilta-aamumittauksessa yli 2–3 mmol/l (1,6).
Eri perus- ja ateriainsuliinit
Perus- ja ateriainsuliinien ominaisuudet on lyhyesti esitetty taulukossa (taulukko 1).
NPH-insuliinin käyttöön liittyy sen kineettisistä ominaisuuksista johtuva hypoglykemiariski, sillä sen huippuvaikutus on noin 4–12 tuntia pistoksesta (1,11). NPH tulee sekoittaa ennen pistosta. NPH-insuliinin käyttö on vähentynyt, eikä sitä käytännössä enää käytetä insuliininpuutosdiabeteksessa kuin erityistilanteissa. Sen sijaan kortikosteroidihoidon yhteydessä voidaan hyödyntää NPH:n vaikutushuippua antamalla pistos aamiaisen ja/tai lounaan yhteydessä (1).
Detemirinsuliini annostellaan T2D-hoidossa yleensä illalla, jolloin vaikutus kohdentuu maksan yöaikaiseen glukoosintuotantoon. Insuliinipuutteiselle potilaalle detemirinsuliini tulee annostella kaksi kertaa päivässä, jotta varmistetaan riittävä perusinsuliinimäärä koko vuorokauden ajaksi. Detemirinsuliinin kaksipistosannostelu mahdollistaa myös erilaisen perusinsuliinimäärän päivällä ja yöllä sekä annoksen muuttamisen liikunnan yhteydessä (1).
Glargininsuliini 100 yks/ml annostellaan tavallisimmin kerran vuorokaudessa. Glargininsuliinista on myös konsentroidumpi versio, 300 yks/ml, jonka vaikutusaika on pidempi kuin glargininsuliinilla 100 yks/ml. Konsentroidumman version etuna on pienempi yöhypoglykemioiden määrä kuin glargininsuliinilla 100 yks/ml (1,14). Glargininsuliini 300 yks/ml annostellaan kerran vuorokaudessa.
Degludekinsuliini annostellaan kerran vuorokaudessa. Sen käyttöön liittyy vähemmän yöhypoglykemioita kuin glargininsuliinilla 100 yks/ml tai detemirinsuliinilla (1,14). Hiljattain julkaistiin verkostometa-analyysi (network meta-analysis) 25 tutkimuksesta (15 746 potilasta). Siinä ei havaittu merkittäviä eroja tehossa tai hypoglykemioiden esiintyvyydessä glargininsuliinin 300 yks/ml ja degludekinsuliinin välillä (17).
Ateriainsuliinihoito
Ateriainsuliinina voidaan käyttää pikavaikutteisia insuliinianalogeja (aspart-, fast acting aspart -eli fiasp-, glulis- tai lisproinsuliini) (taulukko 1). Niillä katetaan aterian sisältämän hiilihydraattikuorman vaikutus plasman glukoosipitoisuuteen (1).
Ateriainsuliinihoito voidaan yhdistää muuhun diabeteshoitoon, jos ongelmana on, että veren glukoosipitoisuus suurenee eniten aterioitten yhteydessä, ja yön aikainen glukoosipitoisuus on muuten hallinnassa.
Ateriainsuliini pistetään 0–20 minuuttia ennen ruokailua, veren glukoosipitoisuudesta ja ruoan tyypistä riippuen. Nopeampivaikutteinen aspartinsuliinin fiasp-muoto otetaan yleensä juuri ennen ateriaa tai enintään 20 minuuttia aterian jälkeen. Ateriaparimittauksilla (ennen ateriaa ja 2 tuntia aterian jälkeen, tavoitteena glukoosipitoisuuden muutos enintään 2–3 mmol/l) haetaan sopivaa ateriainsuliiniannosta (1).
Monipistoshoito
Jos potilaalla on viitteitä insuliininpuutoksesta, tarvitaan insuliinikorvaushoito (1,3). Jos potilaalla on omaa insuliinineritystä, mutta hyperglykemia ei ole hallinnassa muilla insuliinin annostelutavoilla, voidaan myös siirtyä monipistoshoitoon. Siinä perusinsuliiniin yhdistetään ateriainsuliini. Monipistoshoidon periaatteet ovat tyypin 2 diabeteksessa samat kuin tyypin 1 diabeteksessa, mutta insuliiniresistenssistä johtuen insuliinin tarve voi olla suurempi (1).
Sekoiteinsuliinihoito
Jos potilaan elämänrytmi ja ruokamäärät ovat vakaat, voidaan käyttää myös pika- ja pitkävaikutteisen insuliinianalogin yhdistelmää. Sekoiteinsuliineissa on sekoitettuna pikainsuliinia ja sen pitkävaikutteista protamiinisuspensiota (1).
Hoito sekoiteinsuliinilla voidaan aloittaa tai sekoiteinsuliinia voidaan käyttää vain päivän suurimmalla aterialla. Tavallisesti hoito toteutetaan pistoksella aamiaisen ja pääaterian yhteydessä. Sekoiteinsuliinihoidon ongelmana on sen jäykkyys, eli poikkeamat päivittäisessä ruokailussa ja liikunnassa johtavat helposti hypoglykemiaan tai hyperglykemiaan (8). Hypoglykemiat voivat myös lisääntyä ja paino nousta enemmän kuin hoidossa pitkävaikutteisella perusinsuliinilla tai suun kautta otettavilla diabeteslääkkeillä (18). Jos glukoosikontrolli ei ole riittävä oraalisella lääkityksellä, perus- tai ateriainsuliinihoidon yhdistäminen johtaa parempaan glukoositasapainoon kuin sekoiteinsuliinihoito (19).
Insuliinipumppuhoito
Tyypin 2 diabetespotilaan insuliinihoito voidaan tarvittaessa toteuttaa myös insuliinipumppuhoidolla (1). Pumppuhoitoa voidaan harkita, jos glukoosikontrollia ei saada hallintaan monipistoshoidolla (20).
Hoidon ohjaus
Insuliinihoito edellyttää, että potilas saa monipuolisesti tietoa ja ohjausta verenglukoosin omamittauksesta, insuliinin pistämisestä, pistospaikkojen valinnasta, hiilihydraattien laskennasta, insuliiniannosten arvioinnista sekä muiden tekijöiden (liikunta, erilaiset ateriat, sairauspäivät) vaikutuksesta glukoosipitoisuuteen ja insuliinitarpeeseen (1).
Insuliinihoidon riskit
Insuliinihoito lisää hypoglykemian ja painon- nousun riskiä (8). Painonnousun ajatellaan liittyvän glukosurian väistymiseen, hypoglykemioiden esiintymiseen ja liian suureen perusinsuliinin annokseen (1).
Oraalisista diabeteslääkkeistä sulfonyyliureat ja glinidit voivat aiheuttaa hypoglykemiaa ja painonnousua. Myös insuliiniherkistäjä pioglitatsoni voi aiheuttaa painonnousua (1,8). Vaikka sulfonyyliureat ja pioglitatsoni ovat mukana mahdollisina vaihtoehtoina tyypin 2 diabeteksen lääkehoitoalgoritmeissä (1,7), on suositeltu, että niiden käyttö lopetettaisiin insuliinihoitoa aloitettaessa (4,8). Metformiinihoitoa yleensä jatketaan, kun insuliinihoito aloitetaan. Insuliinihoitoon liittyvää hypoglykemiaa ja painonnousua voidaan ehkäistä yhdistämällä hoitoon SGLT2-estäjä tai GLP-1-reseptoriagonisti. Tarvittava insuliiniannos on silloin pienempi (4,6).
Insuliini on kasvutekijä, jolla on mitogeeninen vaikutus kaikkiin soluihin. Monien syöpien ilmaantuvuus ja syöpiin liittyvä kuolleisuus on lisääntynyt hyperinsulineemisissä tiloissa, kuten lihavuus ja tyypin 2 diabetes (21). Tutkimustulokset insuliinianalogien ja syöpäriskin yhteydestä ovat kuitenkin olleet ristiriitaisia, eikä tämänhetkinen näyttö mahdollista tarkempaa suositusta minkään valmisteen puolesta tai vastaan (21,22). Koska syöpäriskin ajatellaan liittyvän hyperinsulinemiaan, insuliiniannos kannattaa pitää maltillisena yhdistämällä hoitoon insuliinin tarvetta vähentäviä elämäntapamuutoksia ja/tai lääkkeitä, kuten metformiini, SGLT2-estäjä ja GLP-1-reseptoriagonisti.
Onko insuliinityypeillä eroa vaikutuksessa kardiovaskulaaririskiin?
Kardiovaskulaarisairaudet ovat tavallisin sairastavuuden ja kuolleisuuden syy tyypin 2 diabeteksessa. Viime aikoina on kiinnitetty erityistä huomiota diabeteslääkkeiden sydänturvallisuuteen.
Laajoissa tutkimuksissa insuliinihoito on osoittautunut neutraaliksi merkittävien sydän- ja verisuonitapahtumien suhteen. Origin-tutkimuksessa glargininsuliinin lisääminen oraaliseen diabeteslääkitykseen ei lisännyt tai vähentänyt kardiovaskulaaritapahtumia (23).
Heart2D-tutkimuksessa verrattiin aterian jälkeisen glukoosipitoisuuden kontrollin ja toisaalta paastoglukoosin / ennen seuraavaa ateriaa mitatun glukoosipitoisuuden kontrollin merkitystä kardiovaskulaaritapahtumien riskiin. Tutkimuksessa satunnaistettiin sairastetun sydäninfarktin jälkeen ateriainsuliiniryhmään (lispro) tai perusinsuliiniryhmään (joko NPH kaksi kertaa päivässä tai glargininsuliini kerran päivässä) 1 115 potilasta, joilla oli tyypin 2 diabetes. Tutkimus keskeytettiin ennenaikaisesti vaikutuksen puutteen vuoksi. Vajaan 3 vuoden seurannan aikana insuliinimuotojen välillä ei ollut eroja kardiovaskulaaritapahtumien suhteen (24).
Ylipitkävaikutteista degludekinsuliinia verrattiin glargininsuliiniin 100 yks/ml tutkimuksessa, jossa 7 637 tyypin 2 diabetespotilasta satunnaistettiin kerran päivässä pistettävälle degludek- tai glargininsuliinille. Potilailla oli joko kardiovaskulaarisairaus tai suuri riski sairastua siihen. Seuranta kesti kaksi vuotta. Ryhmillä ei ollut eroa kardiovaskulaaritapahtumien suhteen (25).
Lopuksi
Oireisessa tuoreessa tyypin 2 diabeteksessa insuliinihoito on usein aiheellinen alkuvaiheessa. Tilapäisesti insuliinihoitoa voidaan tarvita myös tulehdussairauden, kortisonihoidon tai esimerkiksi leikkauksen yhteydessä. Jos tuoreessa tyypin 2 diabeteksessa on insuliininpuutoksen piirteitä, tarvitaan insuliinikorvaushoito (1,2,3). Jos tyypin 2 diabetes on kestänyt yli 10 vuotta ja glykeeminen kontrolli on huono, on todennäköistä, että insuliinineritys on hiipunut (26). Tällöin insuliinihoito on aiheellinen. Se voidaan toteuttaa yksilöllisesti usealla eri tavalla, tarvittaessa muita diabeteslääkkeitä yhdistäen.
Heikki Koistinen: Konsultointi (Sanofi-Aventis), luentopalkkiot (Novo Nordisk), matka-, majoitus tai kokouskulut (Novo Nordisk), Suomen diabetestutkijat ja diabetologit ry:n hallituksen jäsen.
- 1
- Tyypin 2 diabetes. Käypä hoito -suositus. Suomalaisen Lääkäriseuran Duodecimin, Suomen Sisätautilääkärien yhdistyksen ja Diabetesliiton Lääkärineuvoston asettama työryhmä. Helsinki: Suomalainen Lääkäriseura Duodecim, 2020 (viitattu 11.05.2021). www.kaypahoito.fi
- 2
- Ahlqvist E, Storm P, Käräjämäki A ym. Novel subgroups of adult-onset diabetes and their association with outcomes: a data-driven cluster analysis of six variables. Lancet Diabetes Endocrinol 2018;6:361–9.
- 3
- Niskanen L, Laine MK. Tyypin 2 diabeteksen nykyhoito. Suom Lääkäril 2020;75:1680–4.
- 4
- Davies MJ, D’Alessio DA, Fradkin J ym. Management of hyperglycaemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia 2018;61:2461–98.
- 5
- Lean MEJ, Leslie WS, Barnes AC ym. Durability of a primary care-led weight-management intervention for remission of type 2 diabetes: 2-year results of the DiRect open-label, cluster-randomised trial. Lancet Diabetes Endocrinol 2019;7:344–55.
- 6
- 9. Pharmacologic Approaches to Glycemic Treatment: Standards of Medical Care in Diabetes–2021. Diabetes Care 2021;44(Suppl 1):S111-s24.
- 7
- Buse JB, Wexler DJ, Tsapas A ym. 2019 update to: Management of hyperglycaemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia 2020;63:221–8.
- 8
- Wallia A, Molitch ME. Insulin therapy for type 2 Diabetes Mellitus. JAMA 2014;311:2315–25.
- 9
- Li Y, Xu W, Liao Z ym. Induction of long-term glycemic control in newly diagnosed type 2 diabetic patients is associated with improvement of beta-cell function. Diabetes Care 2004;27:2597–602.
- 10
- Weng J, Li Y, Xu W ym. Effect of intensive insulin therapy on beta-cell function and glycaemic control in patients with newly diagnosed type 2 diabetes: a multicentre randomised parallel-group trial. Lancet 2008;371:1753–60.
- 11
- Cahn A, Miccoli R, Dardano A, Del Prato S. New forms of insulin and insulin therapies for the treatment of type 2 diabetes. Lancet Diabetes Endocrinol 2015;3:638–52.
- 12
- Insuliininpuutosdiabetes. Käypä hoito -suositus. Suomalaisen Lääkäriseuran Duodecimin, Suomen Sisätautilääkärien yhdistyksen ja Diabetesliiton Lääkärineuvoston asettama työryhmä. Helsinki: Suomalainen Lääkäriseura Duodecim, 2020 (viitattu 11.05.2021). www.kaypahoito.fi
- 13
- Bretzel RG, Nuber U, Landgraf W, Owens DR, Bradley C, Linn T. Once-daily basal insulin glargine versus thrice-daily prandial insulin lispro in people with type 2 diabetes on oral hypoglycaemic agents (Apollo): an open randomised controlled trial. Lancet 2008;371:1073–84.
- 14
- Aschner P. Insulin therapy in type 2 diabetes. Am J Ther 2020;27(1):e79-e90.
- 15
- Madenidou AV, Paschos P, Karagiannis T ym. Comparative benefits and harms of basal insulin analogues for type 2 diabetes: a systematic review and network meta-analysis. Ann Intern Med 2018;169:165–74.
- 16
- Monami M, Marchionni N, Mannucci E. Long-acting insulin analogues versus NPH human insulin in type 2 diabetes: a meta-analysis. Diabetes Res Clin Pract 2008;81:184–9.
- 17
- Freemantle N, Chou E, Frois C ym. Safety and efficacy of insulin glargine 300 u/mL compared with other basal insulin therapies in patients with type 2 diabetes mellitus: a network meta-analysis. BMJ Open 2016;6(2):e009421.
- 18
- Qayyum R, Bolen S, Maruthur N ym. Systematic review: comparative effectiveness and safety of premixed insulin analogues in type 2 diabetes. Ann Intern Med 2008;149:549–59.
- 19
- Holman RR, Farmer AJ, Davies MJ ym. Three-year efficacy of complex insulin regimens in type 2 diabetes. N Engl J Med 2009;361:1736–47.
- 20
- Reznik Y, Cohen O, Aronson R ym. Insulin pump treatment compared with multiple daily injections for treatment of type 2 diabetes (OpT2mise): a randomised open-label controlled trial. Lancet 2014;384:1265–72.
- 21
- Vigneri R, Sciacca L, Vigneri P. Rethinking the relationship between insulin and cancer. Trends Endocrinol Metab 2020;31:551–60.
- 22
- Weinstock RS. General principles of insulin therapy in diabetes mellitus. UpToDate, 2021 (Literature review current through: Apr 2021. This topic last updated: Mar 01, 2021). (Viitattu 11.05.2021). www.uptodate.com
- 23
- Origin Trial Investigators; Gerstein HC, Bosch J, Dagenais GR ym. Basal insulin and cardiovascular and other outcomes in dysglycemia. N Engl J Med 2012;367:319–28.
- 24
- Raz I, Wilson PW, Strojek K ym. Effects of prandial versus fasting glycemia on cardiovascular outcomes in type 2 diabetes: the Heart2D trial. Diabetes Care 2009;32:381–6.
- 25
- Marso SP, McGuire DK, Zinman B ym. Efficacy and safety of degludec versus glargine in type 2 diabetes. N Engl J Med 2017;377:723–32.
- 26
- Ilanne-Parikka P, Niskanen L. Miksi ja milloin tyypin 2 diabeetikko tarvitsee insuliinia? Kirjassa: Diabetes. Kustannus Oy Duodecim, 2015 (8–9. painos):366–7.
Insulin treatment in Type 2 diabetes
In the case of severe hyperglycaemia, basal insulin may be considered in addition to metformin and lifestyle changes in newly diagnosed type 2 diabetes. Insulin treatment may temporarily be needed to control hyperglycaemia in any acute illness, treatment with corticosteroids or surgery. The capacity for endogenous insulin secretion may diminish in long-standing type 2 diabetes, and insulin replacement therapy may be needed for metabolic control.