Tyypin 1 diabeteksen insuliinihoito
Insuliinihoidon kehitys on nopeutunut viime vuosina.
Hoito on potilaalle haastavaa, sillä yksilöllinen insuliinintarve vaihtelee paljon eri vuorokausina ja vuorokaudenaikoina.
Hyvä omahoito perustuu yhä hoidon yksilölliseen ohjaukseen ja aterioiden hiilihydraattien arviointiin.
Glukoosisensorit ja älykkäät insuliinipumput näyttävät parantavan hoitotasapainoa sekä lapsilla että aikuisilla. Ne myös helpottavat hoitoa.

Tyypin 1 diabetekseen lapsena sairastuneella oli vajaan vuoden mittainen eliniän ennuste ennen insuliinihoitoa 1920-luvun alussa. Haimauutteen, eli insuliinin, veren glukoosipitoisuutta pienentävä vaikutus todettiin eläinkokeissa 1921. Ihmisillä insuliinihoito aloitettiin tammikuussa 1922 (1).
Suomessa ensimmäinen potilas sai insuliinipistoksen elokuussa 1923. Insuliinista oli pitkään pulaa. Toisaalta taudin luontaista kulkua ei tunnettu, joten insuliinihoidon varhaisvaiheessa potilaita kuoli insuliininpuutteeseen sairaalasta kotiuduttuaan. Insuliini oli hyvin kallista, eikä korvausjärjestelmää ollut (2).
Lyhytvaikutteisen insuliinin hyvään hoitokäytäntöön kuului alussa yöllinen insuliinipistos, joten sinkkiprotamiini-insuliini helpotti hoidon aikataulua 30-luvulla. Vuonna 1946 kehitettiin NPH-insuliini, jota saattoi käyttää lyhytvaikutteisen insuliinin kanssa. Keskipitkävaikutteinen kerran päivässä pistettävä lenteinsuliini tuli markkinoille 1956. Seuraavilla vuosikymmenillä kehitettiin yhä puhtaampia insuliineja ja ymmärrys insuliinihoidon fysiologisesta tarpeesta lisääntyi (3).
Ihmisinsuliinin aika
Ihmisinsuliinien käyttöön siirryttiin 1982 (4). Monipistoshoito oli 80-luvun alkupuolella usein kolmipistoshoito. Kohti todellista monipistoshoitoa siirryttiin insuliinikynien avulla. Insuliinipumppuhoito alkoi yksinkertaisella pumpulla, jossa vuorokauden perusinsuliinin määrä annosteltiin vakionopeuksisella infuusiolla. Aterioiden yhteydessä annettiin pumpun kautta lisäinsuliiniannokset.
1980-luvun lopussa esitettiin, miten insuliininerityksen pulssikäyrä vaihtelee terveillä ihmisillä vuorokauden mittaan (5). Kahdesti päivässä pistettävän NPH-insuliinin huippuvaikutuksen ja lyhytvaikutteisen humaani-insuliinin hitaan vaikutuksen yhdistelmä oli vielä kaukana fysiologisen insuliinihoidon tavoitteesta. Insuliinipumppuhoidon kehittyessä pumppuun voitiin ohjelmoida aamuyölle perusinsuliinitason nosto, jolla aamunkoittoilmiö saatiin paremmin hallintaan.
Insuliinianalogit
Aiempaa nopeammin vaikuttava ateriainsuliini, insuliinianalogi lispro, tuli käyttöön 1996 ja auttoi hallitsemaan veren glukoosipitoisuuden suurenemista aterian jälkeen. Lisproinsuliinia seurasivat aspart- ja glulisinsuliinit. Näitä lyhytvaikutteisia analogeja käytettäessä ateriainsuliini on pistettävä ainakin 15 minuuttia ennen ateriaa, jotta saavutetaan hyvä glukoosipitoisuus aterian jälkeen.
Suomessa uusin ateriainsuliini on vuodesta 2017 käytetty aspartinsuliinista kehitetty nopeampivaikutteinen insuliinianalogi faster insulin aspart (fiasp) -insuliini. Nopeammat ateriainsuliinit ja hiilihydraattilaskenta korostavat diabeteshoitajan antaman hoidonohjauksen merkitystä.
NPH-insuliinin huippuvaikutuksen ja lyhyen vaikutusajan vuoksi on kehitetty pitkävaikutteisempia insuliinianalogeja, jotka vaikuttavat myös mahdollisimman tasaisesti ilman merkittävää hypoglykemialle altistavaa huippuvaikutusta. Niistä on Suomessa ollut vuodesta 2000 käytössä glargininsuliini pistettynä 1–2 kertaa päivässä ja vuodesta 2004 detemirinsuliini kahtena pistoksena päivässä korvaamaan puuttuvaa perusinsuliinia.
Viime vuosina markkinoille on tullut uusina perusinsuliineina kaksi pitkävaikutteista insuliinianalogia, glargininsuliini 300 yksikköä / ml ja degludekinsuliini. Niiden vaikutus on tasaisempi ja pidempi kuin aiemmilla insuliinianalogeilla. Nyt markkinoilla olevat insuliinit ja niiden vaikutusajat on esitetty taulukossa (taulukko 1) (6) ja insuliinihoidon kehitys kuviossa (kuvio 1).
Vuorokausivirtsan glukoosimittauksista
glukoosisensorointiin ja älypumppuihin
Verenglukoosin päivittäinen seuranta syrjäytti virtsan glukoosimittaukset glukoositasapainon tarkkailussa 80-luvun alussa. Pitkäaikaisen verenglukoosin seurannassa oli jo silloin käytössä HbA1-mittaus (nyt HbA1c), joka osoittaa keskimääräisen päivittäisen glukoositason edeltävän 6–8 viikon aikana. DCCT-tutkimus (Diabetes control and complications trial) 1993 osoitti hyvän glukoositasapainon merkityksen tyypin 1 diabeetikon elinajan ennusteelle. Se oli merkittävin tutkimuksista, joiden perusteella glykosyloituneen hemoglobiinin (HbA1c) tavoitetasoksi vähitellen vakiintui 53 mmol/mol. Tutkimuksen tavoitteeseen liittyi glukoosin sormenpäämittaus 5 kertaa päivässä (7).
HbA1c-määrityksen heikkous on, ettei se ota huomioon veren glukoosipitoisuuden yksilöllistä vaihtelua vuorokauden eri aikoina. Se ei siksi välttämättä tunnista kaikkia potilaita, joilla on riski saada diabetekseen liittyviä elinkomplikaatioita (8). Toisaalta HbA1c:n perusteella ei voi myöskään arvioida hypoglykemiariskiä.
Jatkuva ihonalainen glukoosisensorointi tuli markkinoille vuonna 2000: ensin sokkosensorit ja sitten glukoosisensorit, joissa on näyttö. Suomessa on nyt myynnissä kolme glukoosisensoria: jatkuva, jaksoittainen 14 vrk:n sensori, joka vaatii skannauksen päätelaitteella tai älypuhelimella, 10 vrk:n jatkuva, kalibroimaton sensori ja 7 vrk:n kalibroitava glukoosisensori.
Jatkuva glukoosiseuranta on hyvää vauhtia syrjäyttämässä sormenpäämittaukset, sillä mittaushetken glukoosipitoisuuden lisäksi sensori kertoo pitoisuuden muutoksen suunnan. Tämä helpottaa potilaan hoitopäätöksiä. Modernit sensorit varoittavat sekä kehittyvästä hypo- että hyperglykemiasta.
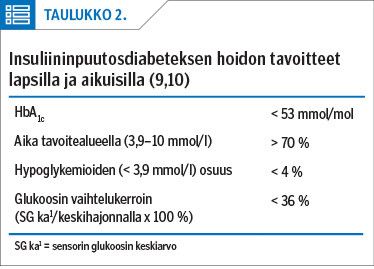
Kun glukoosisensorointi on yleistynyt, on alettu ymmärtää veren glukoosipitoisuuden vaihtelun merkitys elinkomplikaatioiden kehittymisessä. Perinteisen HbA1c:n rinnalle on siksi kehitetty uusia hoidon seurantaparametrejä: glukoosisensorin 14 vuorokauden glukoosikäyrän mukainen aika tavoitetasolla (time in range, TIR) (3,9–10,0 mmol/l), hypoglykemioiden osuus (%) (time below range, TBR), sensorin glukoosin keskiarvo ja keskihajonta sekä näistä laskettava vaihtelukerroin (coefficient of variance, CV) (9,10).
Glukoosisensorointi nopeutti insuliinipumppujen kehitystä. Markkinoille tuli ensin pumppu, jossa oli matalan pysäytys -toiminto, ja sitten pumppu, jossa oli ennakoiva matalan pysäytys.
Ensimmäinen kaupallinen älypumppu, ns. hybridikeinohaima, tuli myyntiin Euroopassa 2018. Se säätelee automaattisesti insuliinin annostelua glukoosisensorin tuottaman datan ja pumpun säätöalgoritmin avulla (11). Hiilihydraattien arvioinnilla ja syöttämisellä pumpun annosoppaaseen on vielä suuri merkitys, mutta tulokset ovat silti varsin hyviä. Aikuisilla glukoosi on tavoitetasolla keskimäärin 70 % ajasta, lapsilla 65 % ajasta, ja hypoglykemiat vähentyvät samalla (12,13,14).
Hybridikeinohaimasta on tullut myös kehittyneempi versio, jota käytettäessä hiilihydraatteja ei enää tarvitse laskea yhtä tarkkaan. Algoritmi osaa myös annostella korjausinsuliinia. Tuoreen satunnaistetun tutkimuksen mukaan aika tavoitealueella lisääntyy ja hypoglykemiat vähenevät käytettäessä kehittyneempää annostelualgoritmia (15). Älypumpun käyttö on myös arvioitu todennäköisesti kustannusvaikuttavaksi hoidoksi (16).
Hoidon tavoitteet
Teknologian ja insuliinien parantuessa hoidon tavoitteet ovat tiukentuneet (taulukko 2). Suomessa tavoitteet ovat lapsilla ja aikuisilla samat (pois lukien raskaana olevat ja vanhukset). Diabetespotilaiden hoitotasapaino ei ole edistysaskeleista huolimatta kuitenkaan parantunut tavoitetasolle, vaikka jatkuva glukoosisensorointi vaikuttaa hoitotasapainoon suotuisasti ja tulos vaikuttaa pysyvän kolmen vuoden seurannassa (17).
Yhdysvalloissa tehdyn suuren Exchange-tutkimuksen mukaan vain 21 % aikuisista saavutti HbA1c-tason alle 53 mmol/mol ja 17 % lapsista HbA1c-tason alle 58 mmol/mol (18). Diabetesliiton kyselyssä lasten hoitoyksiköille alle 16-vuotiaiden diabetespotilaiden HbA1c-keskiarvo koko Suomessa oli 60 mmol/mol (7,6 %) (Anu Heikkilä, suullinen tiedonanto). Tuoreimmassa kansallisessa FinnDiane-tutkimuksessa aikuisten diabetespotilaiden Hba1c-taso on parantunut 10 viime vuoden aikana keskiarvosta 68 mmol/mol tasolle 64 mmol/mol vuonna 2020 (Carol Forsblom, suullinen tiedonanto).
Hyvä hoitotasapaino on tärkeä jo lapsuudessa, jotta diabetekseen liittyvät elinkomplikaatiot saataisiin minimoitua. Suuressa ruotsalaisessa lasten diabetesrekisteritutkimuksessa HbA1c-arvoilla yli 53 mmol/mol alkoi esiintyä lieviä elinkomplikaatioita (19,20).
Lasten diabeteksen hoito on kuitenkin vanhemmille vaativaa ja usein henkisesti kuormittavaa (21). Jokaisen tyypin 1 diabetesta sairastavan lapsen hoitomuoto pitäisikin valita siten, että hoito olisi mahdollisimman helppoa eikä heikentäisi perheen elämänlaatua. Insuliinipumppuhoito parantaa lasten ja nuorten hoitotasapainoa ja vähentää komplikaatioiden ilmaantuvuutta, etenkin yhdistettynä jatkuvaan glukoosisensorointiin (22,23). Annosoppaan käyttö parantaa glukoositasapainoa ja elämänlaatua sekä vähentää hoidon kuormittavuutta (24). Älypumput parantavat glukoositasapainoa vielä huomattavasti tehokkaammin kuin sensoroiva insuliinipumppu tai monipistoshoito, ja tulos näyttää säilyvän vuoden seurannassa (13,24).
Yksilöllisen hoidon merkitys korostuu ihmisen ikääntyessä (25). Kun vanhus on sairastanut insuliininpuutosdiabetesta pitkään, hoidon tavoitteita joudutaan miettimään uudelleen, jos ilmenee elinajan ennustetta heikentäviä elinmuutoksia tai todetaan muita vaikeita kroonisia sairauksia (taulukko 3). Vanhuksen muistin, näkökyvyn, ravitsemustilan ja mahdollisen ortostaattisen hypotension ohella on kiinnitettävä huomiota hypoglykemioiden esiintymiseen ja tunnistamiseen.
Lähiomaisen havainnot ovat tärkeitä omahoitoa arvioitaessa. Toisaalta ikä ei estä jatkuvaa glukoosiseurantaa modernin insuliinihoidon oleellisena osana, jos itsenäisesti asiansa hoitavan 80-vuotiaan ihmisen insuliininpuutosdiabetekseen ei liity vaikeita elinmuutoksia eikä hänellä ole todettu selviytymistä heikentävää muistisairautta.
Miksi insuliinihoito on vaikeata?
Elimistön insuliininerityksen jäljittely on yhä hyvin vaativaa huolimatta insuliinivalmisteiden ja annostelua helpottavan teknologian huimasta edistyksestä. Insuliinin tarpeen on osoitettu vaihtelevan yksilöllisesti päivästä ja yöstä toiseen (26,27,28). Glukoosipitoisuuden vaihtelu yöaikaan on tullut jatkuvan glukoosisensoroinnin aikakautena selvästi esiin kliinisen työn haasteena (26,29).
Insuliinin tarpeeseen vaikuttavat myös useat hormonaaliset tekijät. Nykyään tunnistetaan jo hyvin aamunkoittoilmiö, get up-ilmiö ja illankoittoilmiö. Aamunkoittoilmiössä potilaan verensokeritaso alkaa nousta varhain aamulla (noin klo 5), ja get up -ilmiössä se kohoaa tuntuvasti heti sängystä noustessa (30,31). Illankoittoilmiössä (dusk phenomenon) verensokeritaso lähtee jyrkkään nousuun nukkumaanmenon jälkeen huolimatta hyvästä tasosta iltapalan jälkeen tai iltapalan laadusta (31,32). Insuliinihoidon kannalta on haasteellista, ettei illankoittoilmiö esiinny välttämättä samanlaisena viikosta toiseen, vaan tilanne vaihtelee.
Näiden ilmiöiden syitä ei tarkkaan tiedetä. Tutkimuksissa on kuitenkin havaittu kasvuhormonin erityksen lisääntyvän ennen veren glukoosipitoisuuden suurenemista (30).
Insuliinihoidon toteuttamiseen kuluu huomattavan paljon potilaan aikaa. Se on myös raskasta ja edellyttää laajaa ennakointia: aterioiden hiilihydraattien (ja rasvan sekä proteiinien) arviointi, insuliinin annostelu ja sen ajoitus sekä sovittaminen fyysiseen aktiivisuuteen on jatkuvaa ja vaatii useita suuria hoitopäätöksiä päivässä. Siksi on hyvin inhimillistä, ettei hoidon tavoitteita ole helppo saavuttaa.
Insuliinihoito eri ikäkausina
Monipistoshoidon toteutus aikuisilla
Hyväkuntoiselle tyypin 1 diabetesta sairastavalle insuliinihoito voidaan aloittaa pitkävaikutteisella insuliinilla annoksella 0,1–0,2 U / painokilo – muistisääntönä tällöin aikuisille yleensä noin 10 yksikköä.
Insuliinihoidon alkuvaiheen jälkeen on tyypillisesti todettavissa haiman oman insuliininerityksen osittainen toipuminen. Oman insuliininerityksen hiipuessa korostuu ensin ateriainsuliinin tarve, ja sitä seuraa siirtyminen insuliininpuutoksen korvaushoitoon sekä perus- että ateriainsuliinin käytössä. Monipistoshoidon perusinsuliiniannos on kohdallaan, jos glukoositaso on yöllä vakaa eikä nouse tai laske merkittävästi aterioiden välillä päivällä.
Insuliinin vuorokautinen tarve on tyypin 1 diabetespotilaalla keskimäärin 0,5–1,0 yksikköä painokiloa kohti (34). Perusinsuliiniannoksen osuus vuorokauden insuliiniannoksesta on yleensä noin 40–50 %, ja loput annostellaan ateriainsuliinina. Aamupalalle tarvitaan heräämisen ja aamunkoittoilmiön takia suhteessa hieman enemmän insuliinia (31).
Jokaiselle tyypin 1 diabetesta sairastavalle on tehtävä yksilöllisesti insuliiniherkkyyden arvio suhteessa arvioituun hiilihydraattimäärään ja mitattuun glukoosipitoisuuteen. Aikuisilla yhden yksikön teho vastaa usein noin 10:tä grammaa hiilihydraattia.
Toisaalta jos veren glukoosipitoisuus on koholla ennen ateriaa, on arvioitava mahdollinen korjausinsuliinin tarve. Korjausinsuliinin teho saattaa vaihdella paljon yksilöllisesti, vaikka monella aikuisella onkin havaittavissa yhden ateriainsuliiniyksikön pienentävän veren glukoosipitoisuutta noin 2–3 mmol/l.
Insuliiniannosta arvioitaessa on hiilihydraattien määrän ohella otettava huomioon liikunta ja erityistilanteet, kuten sairauspäivät. Jos ruoka on runsasrasvaista ja proteiinipitoista, kuten lasagne tai pizza, kannattaa harkita arvioidun insuliiniannoksen jakamista niin, että osa pistetään ennen ateriaa ja osa sen jälkeen (35). Ateriainsuliini kannattaa pistää jo selvästi ennen ateriaa, jos käytössä on lispro, aspart- tai glulisinsuliini. Myös fiaspinsuliini on hyvä pistää mieluummin ennen ateriaa kuin sen jälkeen – varsinkin aamulla jo hieman ennen aamupalaa. Aikuisten insuliinipumppuhoitoa on kuvattu tarkemmin toisaalla (36,37).
Lasten insuliinihoito
Suomessa noin puolella diabetesta sairastavista lapsista on monipistoshoito ja noin puolella insuliinipumppuhoito (38). Glukoosisensorointia käytti v. 2020 lähes 100 % suomalaisista lapsipotilaista (Anu Heikkilä, suullinen tiedonanto). Älypumput yleistyvät nopeasti kaikenikäisillä lapsipotilailla.
Alle kouluikäisten lasten hoidon haasteita ovat pieni kokonaisinsuliinimäärä, hyvin vähäinen insuliinin tarve yöaikaan ja illankoittoilmiö (26,27,33). Perusinsuliinin osuus on usein vain 30–35 % kokonaisinsuliinin tarpeesta (23).
Alle 3-vuotiaiden lasten diabeteksen hoito aloitetaan siksi suoraan sensoroivalla insuliinipumpulla, ja tätä vanhemmillekin valitaan pumppuhoito, jos perhe niin toivoo. Insuliinipumpulla päästään annostelutarkkuuteen 0,025 yksikköä, ja perusinsuliinin annostelua voidaan säätää tunti tunnilta. Kun insuliinipumppujen annostelutarkkuus on parantunut, laimennettua insuliinia ei ole enää useimmiten tarpeen käyttää edes vauvaikäisille diabetespotilaille (38). Aamupalalle annosteltavan insuliinin määrä on pienillä lapsilla myös tyypillisesti suuri suhteessa muihin aterioihin.
Kouluikäisillä lapsilla insuliinin tarve on useimmiten 0,7–1 yksikköä / painokilo (6). Perusinsuliinin tarve on 40–50 % koko päivän tarpeesta. Illankoittoilmiö vaihtelee, ja ero insuliinin tarpeessa liikuntapäivinä ja vapaapäivinä suurenee. Joustavuutta siis kaivataan. Siksi hoito perusinsuliinilla toteutetaan monipistoshoidossa useimmiten kahdesti päivässä annosteltavalla detemirinsuliinilla, jotta potilas voi muuttaa esimerkiksi illan annosta sen mukaan, onko päivällä liikuttu vai ei.
Ateriainsuliineina kouluikäisillä käytetään, kuten aikuispotilailla, kaikkia markkinoilla olevia pikainsuliinianalogeja potilaan tarpeen mukaan. Hiilihydraattien laskemista opetellaan, ja myös rasvojen ja proteiinien huomioiminen insuliinihoidossa alkaa olla entistä enemmän tarpeen. Yhteistyö ravitsemusterapeuttien kanssa on keskeistä. Monipistoshoito ja insuliinipumppuhoito ovat tässä ikäryhmässä yhtä suosittuja, vaikkakin hoidon hienosäätö on helpompaa pumppuhoidolla.
Murrosikää lähestyttäessä aamunkoittoilmiö alkaa yleistyä: veren glukoositaso alkaa nousta aamuyön tunteina johtaen helposti hyperglykemiaan aamulla. Silloin insuliinipumppu saattaa olla ainut vaihtoehto hoitomuotona. Murrosiän hormonitoiminta saa muutenkin insuliinin tarpeen kasvamaan reilusti, jopa 2 yksikköön / painokilo (39). Perusinsuliinin osuus on usein 50 %, erittäin liikunnallisilla nuorilla vähäisempää. Diabeteksen hoito on teini-iässä monesti haastavaa. Usein saattaa olla järkevää käyttää pitkävaikutteista analogia, jonka pistosajankohta saa vaihdella.
Lopuksi
Insuliinihoito on arjessa yhä haastavaa potilaille ja kuormittavaa lapsipotilaiden sekä vanhusten omaisille. Kansainvälisiä hoidon tavoitteita ei vielä ole saavutettu, mutta moderni diabetesteknologia antaa toivoa. Kaikkien hoitoon sitoutuvien diabetespotilaiden käyttöön pitäisi saada uusimmat hoitokeinot, jotta hoitotasapaino saataisiin paremmaksi ja yhteiskunnalle kalliilta elinkomplikaatioilta vältyttäisiin.
Markku Saraheimo: Konsultointi (Medtronic), asiantuntijalausunto (Eli Lilly Finland Oy, Novo Nordisk), luentopalkkiot (Abbott, Astra Zeneca, Boehringer Ingelheim, Eli Lilly, Infucare, Medtronic, Mundipharma, Sanofi Aventis), Advisory board -jäsenyys (Abbot, Astra Zeneca, Infucare, Medtronic, Mundipharma, Novo Nordisk).
Anna-Kaisa Tuomaala: Konsultointi (Medtronic), apurahat laitokselle (Medtronic), luentopalkkiot (Medtronic, Nordic Infucare, Abbott, Sanofi, Novo Nordisk), korvaus koulutusaineiston tuottamisesta (Medtronic), Advisory board -jäsenyys (Abbott, Medtronic, Sanofi).
- 1
- Bliss M. The discovery of insulin. 1. painos, Chicago. University of Chicago Press 1982,59–108.
- 2
- Saraheimo M. Ensimmäinen insuliinihoitoa saanut diabeetikko Suomessa. Lääketieteellinen aikakauskirja Duodecim 1990;9:782–5.
- 3
- Gallaway JA. Diabetes Mellitus. 9. painos, Indianapolis. Lilly Research Laboratories, 1988:105–37.
- 4
- Landgraf W, Sandow J. Recombinant human insulins-clinical efficacy and safety in diabetes therapy. Eur Endocrinol 2016;12:12–17. DOI:10.17925/EE.2016.12.01.12
- 5
- Polonsky KS, Given BD, Van Cauter E. Twenty-four-hour profiles and pulsatile patterns of insulin secretion in normal and obese subjects. J Clin Invest 1988;81:442–8. DOI: 10.1172/JCI113339
- 6
- Danne T, Phillip M, Buckingham B ym. ISPAD clinical practice consensus guidelines 2018: Insulin treatment in children and adolescents with diabetes. Pediatric Diabetes 2018;19(Suppl. 27):115–35. DOI: 10.1111/pedi.12718
- 7
- The Diabetes control and complications trial research group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993;329:977–86.
- 8
- Zhen-Ye Zhang, Ling-Feng Miao, Ling-Ling Qian ym. Molecular mechanims of glucose fluctuations on diabetic complications. Front Endocrinol (Lausanne) 2019;10:640. DOI: 10.3389/fendo.2019.00640
- 9
- Battelino T, Danne T, Bergenstal R ym. Clinical targets for continuous glucose monitoring data interpretation: recommendations from the international consensus on time in range. Diabetes Care 2019;42:1593–603. DOI: 10.2337/dci19-0028
- 10
- Danne T, Nimri R, Battelino T ym. International consensus on use of continuous glucose monitoring. Diabetes Care 2017;40:1631–40.
- 11
- Tuomaala A, Sandini L, Haro S. Kohti keinohaimaa. Suom Lääkäril 2018;73:773–8.
- 12
- Lee S, Shin J, Cordero T, Kaufman F. Glycemic outcomes during Minimed 670g system use in children aged 2-6 years with T1D. ATTD19-0488. Abstract.
- 13
- Breton M, Kanapka L, Beck R ym. A randomized trial of closed-loop Ccntrol in ihildren with type 1 diabetes. N Engl J Med 2020;383:836–45.
- 14
- Aleppo G, Webb K. Integrated insulin pump and continuous glucose monitoring technology in diabetes care today: a perspective of real-life experience with the Minimed™ 670G hybrid closed-loop system. Endocrine Practice 2018;24:684–92. https://doi.org/10.4158/EP-2018-0097.
- 15
- Bergenstal R, Nimri R, Beck R ym. A comparison of two hybrid closed-loop systems in adolescents and young adults with type 1 diabetes (FLAIR): a multicentre, randomised, crossover trial. Lancet 2021;397:208–19. https://doi.org/10.1016/S0140-6736(20)32514-9.
- 16
- Jendle J, Pöhlmann J, de Portu S, Smith-Palmer J, Roze S. Cost-effectiveness analysis of the MiniMed 670G hybrid closed-loop system versus continuous subcutaneous insulin infusion for treatment of type 1 diabetes. Diabetes Technol Ther 2019;21:110–18. DOI: 10.1089/dia.2018.0328
- 17
- Šoupal J, Petruželková L, Grunberger G ym. Glycemic outcomes in adults with T1D are impacted more by continuous glucose monitoring than by insulin delivery method: 3 years of follow-up from the Comisair Study. Diabetes Care 2020;43:37–43. DOI: 10.2337/dc19-0888
- 18
- Foster NC, Roy W, Beck RW ym. for the T1D exchange clinic network. State of type 1 diabetes management and outcomes from the T1D exchange in 2016–2018. Diabetes Technol Ther 2019;21:66–7. https://doi.org/10.1089/dia.2018.0384
- 19
- Donaghue KC, Chiarelli F, Trotta D, Allgrove J, Dahl-Jorgensen K. Microvascular and macrovascular complications associated with diabetes in children and adolescents. Pediatric Diabetes 2009:10 (Suppl. 12):195–203.
- 20
- Lind M, Pivodic A, Svensson A-M ym. HbA1c level as a risk factor for retinopathy and nephropathy in children and adults with type 1 diabetes: Swedish population based cohort study. BMJ 2019;366:l4894
- 21
- Iversen AS, Graue M, Haugstvedt A ym. Being mothers and fathers of a child with type 1 diabetes aged 1 to 7 years: a phenomenological study of parents’ experiences. Int J Qual Stud Health Well-being 2018;13:1487758. https://doi.org/10.1080/17482631.2018.1487758
- 22
- Szypowska A, Schwandt A, Svensson J ym. Sweet Study Group. Insulin pump therapy in children with type 1 diabetes: analysis of data from the Sweet registry. Pediatr Diabetes 2016;Suppl 23:38–45. doi: 10.1111/pedi.12416. Epub 2016 Jul 15. PMID: 27417128.
- 23
- Sherr JL, Tauschmann M, Battelino T ym. Ispad Clinical Practice Consensus Guidelines 2018: Diabetes technologies. Pediatric Diabetes 2018;Suppl 27:302–25. DOI: 10.1111/pedi.12731.
- 24
- Petrovski G, Al Khalaf F, Campbell J ym. One‑year experience of hybrid closed‑loop system in children and adolescents with type 1 diabetes previously treated with multiple daily injections: drivers to successful outcomes. Acta Diabetol 2021;58:207–13. https://doi.org/10.1007/s00592-020-01607-4
- 25
- American Diabetes Association. Older adults: standards of medical care in diabetes — 2020. Diabetes Care 2020;43(Suppl. 1):S152-S162).
- 26
- Dovc K, Boughton C, Tauschmann M ym. Young children have higher variability of insulin requirements: Observations during hybrid closed-loop insulin delivery. Diabetes Care 2019;42:1344–7. https://doi.org/10.2337/dc18-2625.
- 27
- Tauschmann M, Hovorka R. Insulin delivery and nocturnal glucose control in children and adolescents with type 1 diabetes. Expert Opin Drug Deliv 2017;14:1367–77. DOI: 10.1080/17425247.2017.1360866
- 28
- Bekiari E ym. Artificial pancreas treatment for outpatients with type 1 diabetes: systematic review and meta-analysis. BMJ 2018;361. https://doi.org/10.1136/bmj.k1310
- 29
- Ruan Y, Thabit H, Leelaratha L ym. Variability of insulin requirements over 12 weeks of closed-loop insulin delivery in adults with type 1 diabetes. Diabetes Care 2016;39:830–9. DOI:10.2337/dc15-2623
- 30
- Porcellati F, Lucidi P, Bolli GB, Fanelli CG. Thirty years of research on the dawn phenomenon: lessons to optimize blood glucose control in diabetes. Diabetes Care 2013;36:3860–2. DOI: 10.2337/dc13-2088
- 31
- Freckmann G, Jovanovic L, Baumstark A, Haug C, van der Helm W. The Circadian Study: the get-up phenomenon in type 1 diabetes. Diabetes Care 2008;31:e85. DOI: 10.2337/dc08-1252
- 32
- Li W, Du SN, Shi MJ, Sun ZZ. Spontaneous and transient predinner hyperglycemia in some patients with diabetes: dusk phenomenon. Medicine (Baltimore) 2016;95:e5440. doi:10.1097/MD.0000000000005440
- 33
- Nicolajsen T, Samuelsson A, Hanas R. Insulin doses before and one year after pump start: children have a reversed dawn phenomenon. J Diabetes Sci Technol 2012;6:589–94. doi:10.1177/193229681200600314
- 34
- Hirsch IB. Type 1 diabetes and the use of flexible insulin regimens. Am Fam Physician 1999;60:2343–52, 2355–6.
- 35
- Chase HP, Saib SZ, MacKenzie T, Hansen MM, Garg SK. Post-prandial glucose excursions following four methods of bolus insulin administration in subjects with type 1 diabetes. Diabet Med 2002;19:317–21. doi: 10.1046/j.1464-5491.2002.00685.x. PMID: 11943004.
- 36
- Saraheimo M, Honkasalo M, Miettinen M. Insuliinipumppuhoito: kenelle ja miksi? Lääketieteellinen aikakauskirja Duodecim 2013;129:1571–8. PMID: 24163975.
- 37
- Suomalaisen Lääkäriseuran Duodecimin, Suomen Sisätautilääkärien Yhdistyksen ja Diabetesliiton lääkärineuvoston asettama työryhmä. Insuliininpuutosdiabetes. Käypä hoito -suositus 18.5.2020. www.kaypahoito.fi
- 38
- Heikkilä A. Lasten ja nuorten diabeteksen hoito Suomessa 2016–2018. Diabetesliiton laatukyselyn tuloksia. Diabetes ja lääkäri 2019;48:17–20.
- 39
- Datz N, von Schutz W, Nestoris C ym. Increase of insulin requirements after changing from U40 to U100 insulin in children and adolescents with type 1 diabetes without effect on the metabolic status. Pediatr Diabetes 2008;9:59.
Insulin treatment in type 1 diabetes
The discovery of insulin dates back to 1921. The first injection was given to a young man in Canada in January 1922 and ca. 1.5 years later to a person with diabetes in Finland. During the first years insulin was given many times a day and also once a night. The zinc-protamine in the 30s and NPH-insulin in the mid-40s were developed to act as long-acting insulins to cover the daily basal need of insulin. Lente insulin came onto the market in 1955 with a long duration of action and to be used just once a day. During the following decades the insulin solution became even better purified on the way to development of human insulin and at the same time knowledge about the daily physiological need for insulin grew. The first insulin pump treatments were started at the beginning of the 1980s and the second generation pumps in the mid-80s were already able to take care of the dawn phenomenon. The next step in the development was insulin lispro, which was the first faster acting meal insulin analogue. Accordingly, people with diabetes were taught to count carbohydrates and estimate the need for meal insulin also taking into account the glucose value and physical exercise. In addition to lispro we also have two other meal insulins, insulin aspart and insulin glulisine and in 2017 an even faster insulin aspart went onto the market. During the last 20 years the long-acting insulin analogues have also undergone further development. Besides the longer action these new insulin analogues, such as glargine 100 IU/mol and detemir and later on degludec and glargine 300 IU/ml, also show more even insulin action. Lower frequencies of hypoglycaemia are associated especially with the last two long-acting analogues. In type 1 diabetes ca. 40–50% of daily insulin is based on long-acting insulin and the remaining ca. 50–60% on meal insulins. Twenty years ago the era of glucose sensing by a continuous tissue glucose meter (CGM) began. The CGM acts not just as a meter but also as a continuous teacher and helps people with diabetes to avoid hypoglycaemias and to minimize the daily variation of glucose. The CGM has also been connected to modern insulin pumps on the way to development of smart pumps. In adults and children smart insulin pumps have significantly increased the time on glucose target and at the same time decreased the variation of glucose during the night thus allowing parents to have a good sleep at night.