Papilloomavirus lisää suunielusyöpiä
• Suuren riskin papilloomavirus, erityisesti HPV 16, aiheuttaa syöpää tyypillisesti suunielun alueella. Viruksen epäsuorana osoituksena käytetään p16-proteiinin värjäystä.
• Suunielusyöpien määrä on kasvanut HPV-positiivisten tautien lisääntymisen vuoksi.
• HPV (p16) -positiivinen syöpä eroaa monin tavoin virusnegatiivisesta syövästä.
• Suurin osa HPV (p16) -positiivisista suunielun syövistä hoidetaan (kemo)sädehoidolla, mutta aivan varhaisvaiheen taudissa pelkkä kirurgia voi olla vaihtoehto. Hoitotulokset ovat hyvät.

Pään ja kaulan syövät ovat maailman seitsemänneksi yleisin syöpäryhmä (1). Niiden joidenkin alaryhmien ilmaantuvuus on länsimaissa hieman pienentynyt tupakoinnin vähentymisen ansiosta (2). Suunielusyöpä on kuitenkin yleistynyt huomattavasti monessa maassa parin vuosikymmenen aikana (2,3,4,5,6).
Muutoksen taustalla on ihmisen papilloomaviruksen (HPV) aiheuttamien suunielusyöpätapausten merkittävä yleistyminen (3). Samalla suunielusyövästä on tullut erityisesti miesten tauti (7). Viime vuosina lähes 70 % nielusyövistä Suomessa on todettu miehillä (8).
HPV-osoituksen käytännön hankaluuksien vuoksi merkkiaineena käytetään syöpäkudoksen immunokemiallista p16-värjäystä, jonka ollessa positiivinen syöpä on hyvin todennäköisesti HPV-positiivinen (9). Virus on ajoittain todettavissa myös muissa pään ja kaulan syövissä, mutta sen merkitys ei ole yhtä selvä kuin suunielusyövässä (10). HPV-positiivisen taudin hoitotulokset ja ennuste ovat paremmat kuin HPV-negatiivisen (9).
Ihmisen papilloomavirus
HPV on vaipallinen, kapseliton kaksijuosteinen DNA-virus, josta tunnetaan nykyään pitkälti yli 200 alatyyppiä (11). Ne jaotellaan pienen ja suuren riskin alatyyppeihin karsinogeenisen potentiaalinsa perusteella (12).
Pienen riskin HPV-infektiot, kuten HPV 6 ja HPV 11, voivat aiheuttaa pään ja kaulan limakalvoille hyvänlaatuisia papilloomia, joiden malignisoituminen on äärimmäisen harvinaista (13). Tärkein alatyyppi suunielusyövässä on HPV 16: se on todettavissa lähes 90 %:ssa HPV-infektioon liittyvistä syöpätapauksista, kun taas HPV 18 ja muut alatyypit ovat näissä syövissä harvinaisia (14).
Yhdysvaltalaisen rekisteriselvityksen mukaan onkogeenisen HPV:n vallitsevuus suun limakalvoilla on miehillä 6,0 % ja naisilla 1,1 %. Onkogeenisen HPV-infektion riskiä lisäsivät suuseksipartnerien suuri määrä. Tupakoitsijalla, jolla on lukuisia suuseksipartnereita, todetaan suun limakalvojen suuren riskin HPV-infektio jopa 14,9 %:n todennäköisyydellä (15).
HPV-infektio ei kuitenkaan ole pelkästään seksivälitteinen tauti, sillä infektioita todetaan myös lapsilla. HPV voi tarttua jo sikiöaikana, ja tämä voi altistaa pitkäkestoiselle infektiolle (16,17). Valtaosa onkogeenisista HPV-infektioista paranee noin vuoden kuluessa tartunnasta aiheuttamatta pahanlaatuisia sairauksia (18).
Tyttöjen HPV-rokotus on ollut Suomen kansallisessa rokotusohjelmassa jo joitakin vuosia ja hiljattain ohjelmaan on sisällytetty myös poikien HPV-rokotus.
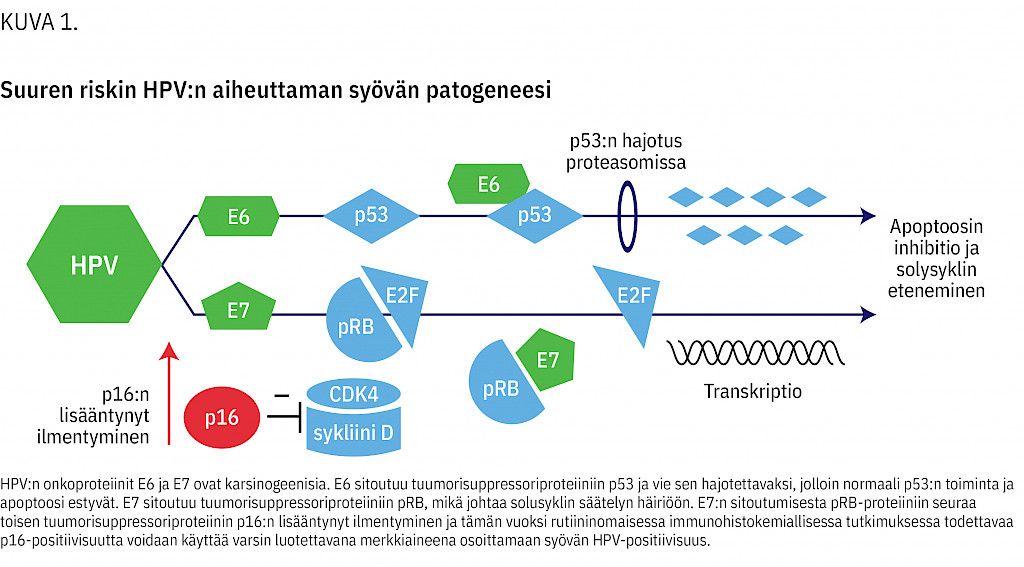
Syövän kehittymisen kannalta HPV:n tärkeimmät onkogeenit ovat E6 ja E7 (kuva 1). Suuren riskin HPV-infektiossa näiden onkogeenien koodaamat onkoproteiinit aiheuttavat syöpää sitoutumalla isäntäsolun tuumorisuppressoriproteiineihin. Onkoproteiini E6 sitoutuu tuumorisupressoriproteiiniin p53, jolloin sen normaalitoiminta estyy. Onkoproteiini E7 estää tuumorisuppressoriproteiini pRB:n toimintaa (12).
Suunielusyöpä
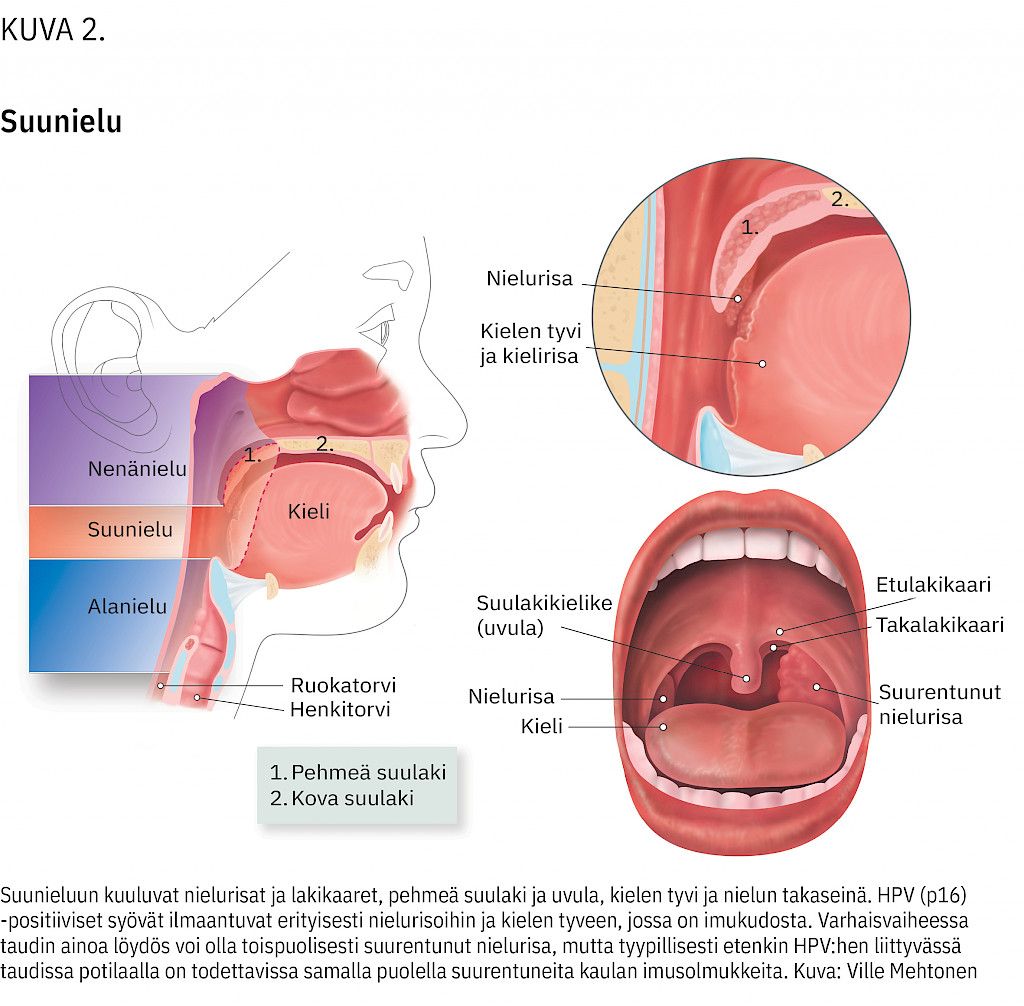
Suunielu on suuontelon taakse, nenänielun alapuolelle ja alanielun yläpuolelle rajautuva alue, johon kehittyvät syövät ovat lähes poikkeuksetta levyepiteelikarsinoomia (kuva 2). Tällä alueella sijaitsevat nielurisat ja kielen tyven kielirisa ovat immunologisesti aktiivista imukudosta.
HPV:n aiheuttamaa suunielusyöpää edeltää oireeton infektio risakudoksessa. Onkin loogista, että HPV-infektioon liittyvä suunielusyöpä kehittyy ensisijaisesti joko nielurisaan tai kielen tyveen, kun taas HPV-infektioon liittymätön suunielusyöpä voi kehittyä mihin tahansa suunielussa.
Toisin kuin esimerkiksi HPV:n aiheuttamassa kohdunkaulan syövässä, suunielusyövästä ei ole voitu osoittaa syövän esiasteita, joihin voitaisiin kohdentaa seulontatoimenpiteitä (19).
HPV-positiivinen suunielusyöpä eroaa monin tavoin HPV-negatiivisesta. HPV-positiiviset potilaat tyypillisesti tupakoivat vähemmän ja käyttävät vähemmän alkoholia (9,20). Lisäksi emokasvain on yleensä pienempi, mutta kaulalle on usein kehittynyt etäpesäkkeitä jo varhaisessa vaiheessa. Kasvain on usein histologisesti huonosti erilaistunut ja siinä on lukuisia molekyylibiologisia eroja HPV-negatiiviseen tautiin verrattuna, kuten immunohistokemiallisesti todettava proteiinin p16 vahva ilmentyminen (21). p16 katsotaan niin merkitykselliseksi tekijäksi taudin jaottelussa, että nykyinen kansainvälinen TNM-luokitus jakaa suunielusyövät kahteen toisistaan eroavaan ryhmään p16-statuksen perusteella (22).
Vuosittain Suomessa todetaan noin 250 suunielusyöpää (8), joista suurin osa on p16 (ja HPV) -positiivisia. Suurella osalla taudin ensimmäisenä merkkinä on kaulalla sijaitseva kyhmy. Vaikka nielurisan tai pehmeän suulaen alueella oleva kasvain on yleensä havaittavissa, yleislääkärin tulisi osata epäillä erityisesti kielen tyven kasvainta vain oireiden tai kaulakyhmyn perusteella ja ohjata potilas erikoislääkärin tutkittavaksi.
Suomalaisessa suunielusyöpäpotilaille tehdyssä kyselytutkimuksessa, jossa suurimmalla osalla oli p16-positiivinen tauti, kahdella kolmasosalla oireena oli kaulakyhmy, hieman alle puolella kipua ja kolmasosalla nielemisvaivoja (23). Toisessa kotimaisessa tutkimuksessa todettiin, että kipua esiintyi useammin HPV-infektioon liittymättömässä taudissa (24). Potilaat hakeutuivat hoitoon keskimäärin 30 päivässä oireiden alkamisesta (23). Syövän oireet tunnistettiin perusterveydenhuollossa hyvin ja potilaat ohjattiin erikoissairaanhoitoon varsin nopeasti, keskimäärin 15 päivässä, ja syöpää osattiin epäillä erityisen hyvin silloin, kun oireena oli kaulakyhmy.
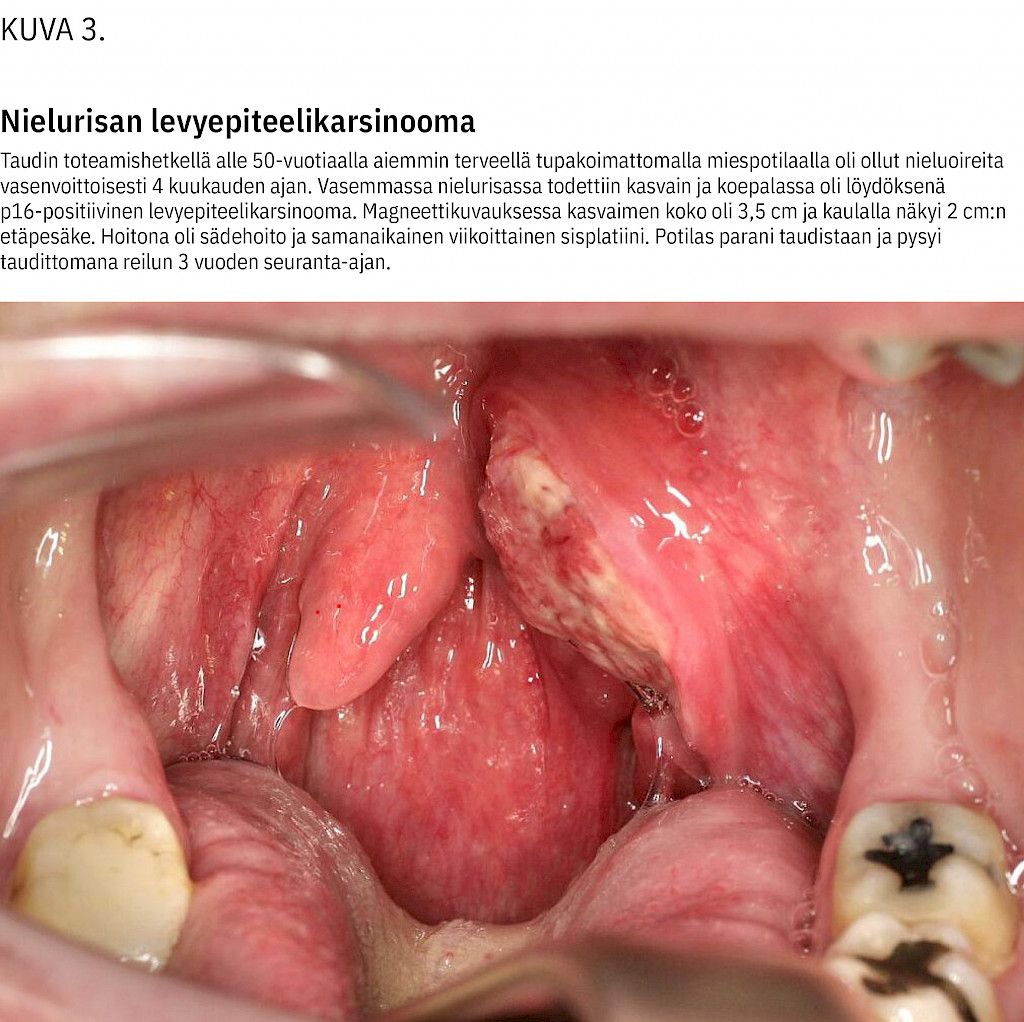
Kun kaulakyhmy tai jokin muu tyypillinen syöpään liittyvä oire tai vastaanotolla havaittu kliininen löydös herättää epäilyn syövästä, potilas tulee ohjata viipymättä erikoissairaanhoitoon, jossa toteutetaan lisätutkimukset (kuva 3). Kaikkien pään ja kaulan syöpäpotilaiden hoitosuunnitelmat käsitellään yliopistosairaaloiden moniammatillisessa hoitokokouksessa.
Hoito
Kirurgialla on ollut suunielusyövän hoidossa aikaisemmin suurempi rooli, ja sillä on yhä sijansa tietyissä tapauksissa (21). Aiemmin kookkaan taudin hoito oli leikkaus ja sen jälkeinen (kemo)sädehoito. Nykyään tavanomaisin p16 (HPV) -positiivisen syövän hoitomuoto on kuratiivistavoitteinen sädehoito tai kemosädehoito, jolloin leikkaus tehdään vain, jos potilaalla on havaittavissa onkologisten hoitojen jälkeen jäännöskasvainta.
Sädehoidon yhteydessä annetaan usein lisäksi taudin laajuuden ja potilaan yleistilan mukaan solunsalpaajahoito, useimmiten sisplatiini. Taudin laajuuden lisäksi hoidon valintaan vaikuttaa erityisesti sen sijainti suunielussa, mutta myös p16-status huomioidaan (www.fshno.fi).
Esimerkiksi kielen tyven alueella (kemo)sädehoito on lähes poikkeuksetta ensisijainen hoito, sillä kielen tyven leikkauksesta aiheutuu merkittävää haittaa elämänlaadulle, ja samalla tulee hoitaa myös kaulan kummankin puolen imusolmukkeet. Myös muualla suunielussa sijaitsevat p16-positiiviset kasvaimet hoidetaan useimmiten (kemo)sädehoidolla, sillä jäännöskasvaimen riski on kohtalaisen pieni.
Pelkkä kirurgia on joskus vaihtoehto varhaisvaiheen taudeissa. p16 (HPV) -negatiivisten tautien hoidossa kirurgialla on merkittävämpi rooli.
Suunielusyövässä kaulalla esiintyy usein piileviä etäpesäkkeitä, vaikka niitä ei palpoiden tai kuvantaen todettaisikaan. Sen vuoksi kaulan imusolmukkeet hoidetaan lähes poikkeuksetta kuvantamislöydöksestä riippumatta. Ne hoidetaan samalla hoitomuodolla kuin emokasvain, joko sädehoidolla tai leikkauksella. Vain hyvin pienet paikalliset taudit voidaan hoitaa pelkällä kirurgialla ilman onkologisia liitännäishoitoja (25,26).
Hoidot ovat potilaille raskaita ja voivat heikentää elämänlaatua (27). Seurauksena on erityisesti nielemisvaikeutta ja -kipua, jotka yleensä helpottuvat merkittävästi hoitojen päätyttyä. Osalle potilaista asennetaan hoidon ajaksi gastrostoomaletku (PEG) turvaamaan riittävää ravinnonsaantia.
Hoitojen päätyttyä potilaita seurataan erikoissairaanhoidossa nykyisin pääsääntöisesti 3 vuoden ajan, sillä uusiutumat kehittyvät yleensä tuon ajan kuluessa. Suomalaisessa selvityksessä havaittiin, että kaikilla potilailla, joille kehittyi uusiutuma, oli myös siihen liittyviä oireita (28).
HPV-positiivista suunielusyöpää sairastavista potilaista kolmen vuoden kohdalla elossa on yli 80 %, HPV-negatiivista tautia sairastavista vain hieman yli puolet (9).
Muut pään ja kaulan alueen syövät
Syöpien kansainvälisessä TNM-luokituksessa p16 (ja HPV) huomioidaan myös silloin, kun potilaalla on lähtökohdaltaan tuntematon kasvain (unknown primary). Kyse on tuolloin kaulalla sijaisevasta levyepiteelikarsinooman etäpesäkkeestä, jonka emokasvain ei ole havaittavissa. Näissä tilanteissa p16-positiivisten etäpesäkkeiden emokasvain sijaitsee todennäköisimmin suunielun alueen risakudoksessa.
Muissa pään ja kaulan alueiden syövissä p16 (HPV) -määritystä ei käytetä kliinisessä työssä, koska niissä HPV:lla ei ole osoitettu olevan vastaavaa merkitystä (29,30). Silti HPV:ta todetaan osassa muitakin pään ja kaulan alueen levyepiteelikarsinoomia (29,30).
Eräiden tutkimusten mukaan suuontelon alueen levyepiteelisyövistä noin 4 %:ssa on osoitettavissa HPV tai p16 (29,30), mutta joissain pienissä aineistoissa luku on suurempikin (31). Varsin tuore laaja tutkimus osoitti, että alanielunsyövistä 21 % oli HPV-positiivisia, ja näillä potilailla ennuste oli parempi kuin muilla (32).
Kurkunpään syövissä HPV:n osuus on pieni, monikansallisessa tutkimuksessa 3,5 % (29). Eräässä toisessa tutkimuksessa osoitettiin, että kookasta kurkunpään tai alanielun syöpää sairastavilla potilailla oli parempi ennuste silloin, kun tauti oli HPV-positiivinen (33).
Länsimaissa hyvin harvinainen nenänielun syöpä liittyy useimmiten Epstein–Barrin virukseen (EBV). Suomalaisessa selvityksessä todettiin, että myös HPV on ajoittain todettavissa nenänielusyövässä ja että sekä HPV- että EBV-positiivisissa nenänielusyövissä potilaiden ennuste on parempi kuin virusnegatiivisissa syövissä (34).
Tuoreen tutkimuksen mukaan nenäkäytävän tai sivuontelon karsinoomaa sairastavien potilaiden ennuste oli parempi silloin, kun tauti oli HPV (tai p16) -positiivinen (35). Tämän alueen syövät ovat melko harvinaisia ja siten tutkimuksen otoskokokin jäi pieneksi.
Myös invertti papillooma on harvinainen, pääosin nenäontelon lateraaliseinämässä tai poskiontelossa esiintyvä hyvänlaatuinen kasvain. Sinonasaalisen invertin papillooman ja HPV-infektion yhteys on epäselvä. Karkeasti noin neljäsosassa sinonasaalisista papilloomista havaitaan HPV-infektio (36), mutta vain suuren riskin alatyyppien esiintymisen on havaittu olevan yhteydessä malignisoitumisriskiin (37).
Laaja, 41 950 pään ja kaulan alueen syöpää käsittävä retrospektiivinen kohorttitutkimus osoitti, että HPV saattaa myös vaikuttaa ennusteeseen suunielusyövän lisäksi eräissä muissa pään ja kaulan alueen syövissä (10).
Muuttuvat hoitokäytännöt
HPV-positiivista suunielusyöpää sairastavien potilaiden määrän kasvu on luonut tarpeen muuttaa hoitosuosituksia, koska näillä potilailla sekä vaste (kemo)sädehoitoon että ennuste on tyypillisesti parempia kuin virusnegatiivista tautia sairastavilla. HPV-positiivista tautia sairastavat potilaat ovat usein nuorempia ja he välttyvät taudin uusiutumalta todennäköisemmin, joten osa kokee pitkään hoitojen jälkeisiä haittavaikutuksia.
Hoitojen keventäminen voi olla hyödyllistä HPV-positiivista tautia sairastaville. Meneillään on useita prospektiivisia satunnaistettuja tutkimuksia, joissa pyritään selvittämään kevennettyjen hoitojen tehoa HPV:hen liittyvässä suunielusyövässä (38). Tutkimustulosten pohjalta myös Suomessa potilaiden seurantaa on jo harvennettu ja lyhennetty aiemmasta, koska rutiininomaisesta seurannasta on osoitettu olevan varsin vähän hyötyä.
Lauri Jouhi, Timo Atula: Ei sidonnaisuuksia.
- 1
- Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2018;68:394–424.
- 2
- Ang KK, Sturgis EM. Human papillomavirus as a marker of the natural history and response to therapy of head and neck squamous cell carcinoma. Semin Radiat Oncol 2012;22:128–42.
- 3
- Chaturvedi AK, Engels EA, Anderson WF, Gillison ML. Incidence trends for human papillomavirus-related and -unrelated oral squamous cell carcinomas in the United States. J Clin Oncol 2008;26:612–9.
- 4
- Carvalho AL, Nishimoto IN, Califano JA, Kowalski LP. Trends in incidence and prognosis for head and neck cancer in the United States: a site-specific analysis of the SEER database. Int J Cancer 2005;114:806–16.
- 5
- Näsman A, Attner P, Hammarstedt L ym. Incidence of human papillomavirus (HPV) positive tonsillar carcinoma in Stockholm, Sweden: an epidemic of viral-induced carcinoma? Int J Cancer 2009;125:362–6.
- 6
- Nichols AC, Palma DA, Dhaliwal SS ym. The epidemic of human papillomavirus and oropharyngeal cancer in a Canadian population. Curr Oncol 2013;20:212–9.
- 7
- Gillison ML, D'Souza G, Westra W ym. Distinct risk factor profiles for human papillomavirus type 16-positive and human papillomavirus type 16-negative head and neck cancers. J Natl Cancer Inst 2008;100:407–20.
- 8
- Finnish Cancer Registry [siteerattu 8.10.2021]. https://syoparekisteri.fi/tilastot/tautitilastot/
- 9
- Ang KK, Harris J, Wheeler R ym. Human papillomavirus and survival of patients with oropharyngeal cancer. N Engl J Med 2010;363:24–35.
- 10
- Li H, Torabi SJ, Yarbrough WG, Mehra S, Osborn HA, Judson B. Association of human papillomavirus status at head and neck carcinoma subsites with overall survival. JAMA Otolaryngol Head Neck Surg 2018;144:519–25.
- 11
- International Human Papillomavirus Reference Center [siteerattu 6.10.21021]. http://www.hpvcenter.se/html/refclones.html
- 12
- Allen CT, Lewis JS Jr, El-Mofty SK, Haughey BH, Nussenbaum B. Human papillomavirus and oropharynx cancer: biology, detection and clinical implications. Laryngoscope 2010;120:1756–72.
- 13
- Syrjänen S, Syrjänen K. HPV-associated benign squamous cell papillomas in the upper aero-digestive tract and their malignant potential. Viruses 2021;13:1624.
- 14
- Kreimer AR, Clifford GM, Boyle P, Franceschi S. Human papillomavirus types in head and neck squamous cell carcinomas worldwide: a systematic review. Cancer Epidemiol Biomarkers Prev 2005;14:467–75.
- 15
- D'Souza G, McNeel TS, Fakhry C. Understanding personal risk of oropharyngeal cancer: risk-groups for oncogenic oral HPV infection and oropharyngeal cancer. Ann Oncol 2017;28:3065–9.
- 16
- Koskimaa HM, Paaso A, Welters MJ ym. Human papillomavirus 16-specific cell-mediated immunity in children born to mothers with incident cervical intraepithelial neoplasia (CIN) and to those constantly HPV negative. J Transl Med 2015;13:370.
- 17
- Koskimaa HM, Paaso AE, Welters MJ ym. Human papillomavirus 16 E2-, E6- and E7-specific T-cell responses in children and their mothers who developed incident cervical intraepithelial neoplasia during a 14-year follow-up of the Finnish Family HPV cohort. J Transl Med 2014;12:44.
- 18
- Kreimer AR, Pierce Campbell CM, Lin HY ym. Incidence and clearance of oral human papillomavirus infection in men: the HIM cohort study. Lancet 2013;382:877–87.
- 19
- Fakhry C, Rosenthal BT, Clark DP, Gillison ML. Associations between oral HPV16 infection and cytopathology: evaluation of an oropharyngeal "pap-test equivalent" in high-risk populations. Cancer Prev Res (Phila) 2011;4:1378–84.
- 20
- Gillison ML, Koch WM, Capone RB ym. Evidence for a causal association between human papillomavirus and a subset of head and neck cancers. J Natl Cancer Inst 2000;92:709–20.
- 21
- Jouhi L, Halme E, Irjala H ym. Epidemiological and treatment-related factors contribute to improved outcome of oropharyngeal squamous cell carcinoma in Finland. Acta Oncol 2018;57:541–51.
- 22
- Brierley JD, Gospodarowicz MK, Wittekind C, toim. TNM Classification of Malignant Tumours, 8. painos. Wiley-Blackwell 2016.
- 23
- Nieminen M, Atula T, Bäck L, Mäkitie A, Jouhi L, Aro K. Factors influencing patient and health care delays in oropharyngeal cancer. J Otolaryngol Head Neck Surg 2020;49:22.
- 24
- Carpén T, Sjoblom A, Lundberg M ym. Presenting symptoms and clinical findings in HPV-positive and HPV-negative oropharyngeal cancer patients. Acta Otolaryngol 2018;138:513–8.
- 25
- Mehanna H, Evans M, Beasley M ym. Oropharyngeal cancer: United Kingdom National Multidisciplinary Guidelines. J Laryngol Otol 2016;130:S90-S6.
- 26
- Jouhi L, Atula T, Saarilahti K ym. Changing trends in the management of the neck in oropharyngeal squamous cell carcinoma. Head Neck 2017;39:1412–20.
- 27
- Ranta P, Kinnunen I, Jouhi L ym. Long-term quality of life after treatment of oropharyngeal squamous cell carcinoma. Laryngoscope 2021;131:E1172-E8.
- 28
- Ilmarinen T, Keski-Säntti H, Markkanen-Leppänen M ym. De-escalation of post-treatment surveillance in oropharyngeal cancer. Head Neck 2019;41:1457–62.
- 29
- Castellsague X, Alemany L, Quer M ym. HPV Involvement in Head and Neck Cancers: Comprehensive Assessment of Biomarkers in 3680 Patients. J Natl Cancer Inst 2016;108:djv403.
- 30
- Paver EC, Currie AM, Gupta R, Dahlstrom JE. Human papilloma virus related squamous cell carcinomas of the head and neck: diagnosis, clinical implications and detection of HPV. Pathology 2020;52:179–91.
- 31
- Hernandez BY, Lynch CF, Chan OTM ym. Human papillomavirus DNA detection, p16(INK4a), and oral cavity cancer in a U.S. population. Oral Oncol 2019;91:92–6.
- 32
- Burbure N, Handorf E, Ridge JA ym. Prognostic significance of human papillomavirus status and treatment modality in hypopharyngeal cancer. Head Neck 2021;43:3042–52.
- 33
- Bates JE, Morris CG, Hitchcock KE, Dziegielewski PT, Mendenhall WM, Amdur RJ. Locally advanced hypopharyngeal and laryngeal cancer: Influence of HPV status. Radiother Oncol 2019;140:6–9.
- 34
- Ruuskanen M, Irjala H, Minn H ym. Epstein-Barr virus and human papillomaviruses as favorable prognostic factors in nasopharyngeal carcinoma: A nationwide study in Finland. Head Neck 2019;41:349–57.
- 35
- Cohen E, Coviello C, Menaker S ym. P16 and human papillomavirus in sinonasal squamous cell carcinoma. Head Neck 2020;42:2021–9.
- 36
- Gupta R, Rady PL, Sikora AG, Tyring SK. The role of human papillomavirus in the pathogenesis of sinonasal inverted papilloma: a narrative review. Rev Med Virol 2021;31:e2178.
- 37
- Ding R, Sun Q, Wang Y. Association between human papilloma virus infection and malignant sinonasal inverted papilloma. Laryngoscope 2021;131:1200–5.
- 38
- Mirghani H, Amen F, Blanchard P ym. Treatment de-escalation in HPV-positive oropharyngeal carcinoma: ongoing trials, critical issues and perspectives. Int J Cancer 2015;136:1494–503.
Human papillomavirus in head and neck cancer
High-risk human papillomavirus (HPV), typically HPV16, causes cancer of the head and neck, especially of the oropharynx. Protein p16 immunohistochemical overexpression is used in clinical work as a surrogate marker for the presence and involvement of HPV. The incidence of oropharyngeal carcinoma (OPSCC) is rising and this trend is mainly attributed to an increase in the incidence of HPV-positive OPSCC. HPV-positive OPSCC is biochemically a distinct disease entity and it differs from its virus-negative counterpart in many respects. HPV-positive OPSCC typically develops in immunologically active lymphoid tissues of the palatine and lingual tonsils, whereas HPV-negative OPSCC also develops elsewhere in the oropharynx. Patients with HPV-positive OPSCC are generally younger, more often male and consume less tobacco and alcohol. In addition, their primary tumours are smaller, but they have more advanced neck disease. However, their disease responds better to treatments and they have a better prognosis. The current TNM classification separates OPSCC into two distinct groups based on p16 (HPV) status. Treatment and follow-up of OPSCC is changing. Surgery has traditionally been the mainstay for OPSCC treatment but today especially patients with HPV-positive OPSCC are treated with (chemo)radiotherapy and surgery is preserved for salvage purposes in the case of residual disease. Head and neck cancer treatments are a significant cause of short-term but also long-term morbidity. There are currently many ongoing prospective randomized trials designed to evaluate potential treatment de-intensification in HPV-positive OPSCC. Among all head and neck cancers, the role of HPV is clearest in OPSCC, but HPV may also be an aetiological and/or prognostic factor in a smaller proportion of carcinomas of other head and neck subsites including the oral cavity, hypopharynx, larynx, nasopharynx and sinonasal cavity.
Lauri Jouhi, Timo Atula
Lauri Jouhi
Dr. Med., Specialising in Otorhinolaryngology
University of Helsinki
lauri.jouhi@helsinki.fi