Pahanlaatuiset kasvaimet haavojen taustalla
• Kroonisen haavan taustalla on pahanlaatuinen kasvain noin 2–4 %:ssa tapauksista.
• Kasvaimeen viittaavat haavan epätyypillinen sijainti, epäsäännölliset reunat, voimakas liikakasvu, herkästi vuotava haavan pohja, epätyypillinen pigmentaatio haavan reunalla sekä huono hoitovaste 4–12 viikon kuluessa.
• Diagnoosi tehdään koepalasta.
• Hoito valikoituu kasvaimen lajin mukaan, mutta ensisijainen hoito on kirurginen.

Kroonisten haavojen lukumäärä lisääntyy väestön ikääntyessä ja diabeteksen lisääntyessä. Niiden aiheuttamat kokonaiskustannukset terveydenhuollolle ovat huomattavat (1). Tanskassa tehdyn arvion mukaan haavapotilaiden osuus koko terveydenhuollon budjetista on 2–4 % (2).
Suurin osa kustannuksista muodostuu sairaanhoitajien ja lääkäreiden käyttämästä työajasta; haavatuotteet muodostavat vain noin 15 % kokonaiskustannuksista (3). Haavapotilaiden haavoja hoidetaan jopa päivittäin tai yleensä vähintään kaksi kertaa viikossa, ja hoitoon kuluu hoitajalta, etenkin alaraajahaavojen ollessa kyseessä, 30 minuutista tuntiin (4). Siten haavapotilaat ovat potilasryhmä, jonka oikea-aikaiseen ja syyhyn kohdennettuun hoitoon kannattaa panostaa.
Ilman etiologiaan kohdennettua hoitoa haavanhoito on tuomittu epäonnistumaan, vaikka nykyaikaisimmat hoitomenetelmät olisivat käytössä. Yleisimmät haavaetiologiat ovat laskimo-, valtimo- tai sekamuotoiset haavat, painehaavat sekä diabeettiset haavat (5). Mikäli edellä mainitut etiologiset syyt eivät ole haavan taustalla tai haava ei lähde paranemaan asianmukaisesta hoidosta huolimatta, on tärkeä muistaa yhtenä etiologisena syynä pahanlaatuiset kasvaimet (6).
Haavaklinikoiden aineistossa on arvioitu, että 2–4 % kaikista kroonisista haavoista on kasvaimen aiheuttamia (7,8,9). Ranskalaisessa prospektiivisessa tutkimuksessa otettiin koepala 144 potilaalta, joiden haava oli kestänyt yli 3 kuukautta ja jotka olivat sairaalassa hoidossa. Maligniteettien esiintyvyys haavoissa näillä potilailla oli peräti 10,4 % (9).
Kasvainten aiheuttamissa haavoissa diagnoosiviive saattaa olla kuukausia, mikä heikentää potilaan ennustetta ja myös lisää haavanhoidon kokonaiskustannuksia (6,7,9,10,11,12). Tämän katsauksen tarkoituksena on kuvata tämän haavaryhmän esiintymistä, kliinistä kuvaa ja hoitoa erityisesti avoterveydenhuollon lääkäreitä silmällä pitäen.
Riskitekijät ja etiologia
Tärkeimpiä altistavia tekijöitä kasvaimen aiheuttamille haavoille ovat muun muassa potilaan ikä, elinikäinen aurinkoaltistus sekä immunosuppressio, kuten taustalla oleva elinsiirto (7,13,14,15,16).
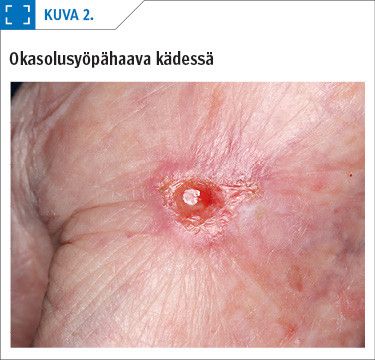
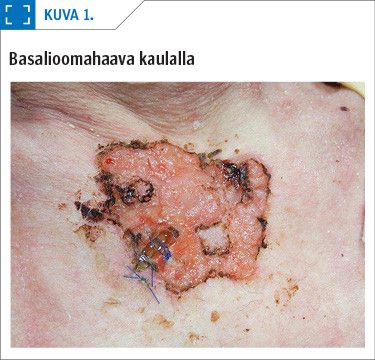
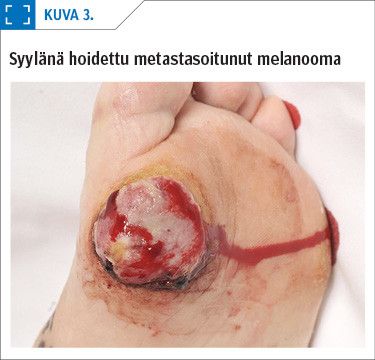
Periaatteessa haavojen taustalla voi esiintyä mikä tahansa pahanlaatuinen ihokasvain. Ne voidaan jakaa primaarisiin haavauttaviin ihokasvaimiin sekä sekundaarisiin haavauttaviin ihokasvaimiin (taulukko 1). Sekundaariset haavauttavat ihokasvaimet syntyvät kroonisiin haavoihin, palovamma-arpiin tai luutulehduksen aiheuttamiin onkaloihin (17). Primaariset haavauttavat ihokasvaimet ovat paljon yleisempiä kuin sekundaariset, ja yleisimpiä niistä ovat basaliooma eli tyvisolusyöpä (kuva 1), okasolusyöpä (kuva 2) ja melanooma (kuva 3).
Muita mahdollisia haavoja aiheuttavia syöpätauteja ovat sarkooma, angiosarkooma, merkelinsolukarsinooma, lymfooma tai Kaposin sarkooma (7,18). Myös mikä tahansa etäpesäkkeitä lähettänyt syöpä voi aiheuttaa iholle haavan (7).
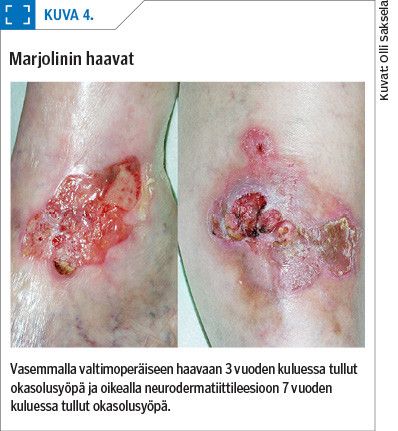
Sekundaariset haavauttavat ihokasvaimet ovat paljon harvinaisempia. Näitä haavoja kutsutaan Marjolinin haavoiksi ranskalaisen kirurgi Jean Marjolinin mukaan. Hän kuvasi kroonisten haavojen ja arpien pahanlaatuistumisen 1900-luvulla (19).
Latenssiaika maligniteetin kehittymiseen on yleensä yli 10 vuotta (11,20). Marjolinin haava on siis krooninen haava, joka muuntuu pahanlaatuiseksi. Yleensä näissä haavoissa tavataan histologisesti okasolusyöpää, mutta myös basaliooman aiheuttamia Marjolinin haavoja on kuvattu (20,21). Altistavina tekijöinä on pidetty krooniseen haavaan tai arpeen liittyvää inflammaatiota ja myös kroonista turvotusta (kuva 4).
Kliininen kuva
Kliinisiä merkkejä haavassa, joiden tulisi herättää epäily maligniteetista, ovat: epätyypillinen sijainti, epäsäännölliset reunat, voimakas liikakasvu, herkästi vuotava haavan pohja sekä epätyypillinen pigmentaatio haavan reunalla. Lisäksi epäilyttävää on, jos pitkäaikaisen kroonisen haavan ulkonäkö muuttuu (Marjolinin haava).
Tyypillinen paikka kasvaimen aiheuttamille haavoille on säären etupinta, toisin kuin esimerkiksi laskimohaavoissa, joiden tyyppipaikkana on kehräsluiden seutu (6,7). Aina kliininen kuva ei ole huolestuttava, ja siksipä koepala tulee ottaa mistä tahansa haavasta, joka ei osoita paranemisen merkkejä 4–12 viikon hyvällä paikallis-, kompressio- tai kevennyshoidolla (6,22).
Diagnoosi
Patologi pystyy diagnosoimaan haavan taustalla mahdollisesti olevan kasvaimen koepalasta. Koepalan ottaminen on helppo ja yksinkertainen toimenpide, joka voidaan tehdä terveyskeskuksessa. Ahkera koepalan otto voi parhaimmassa tapauksessa säästää potilaan hengen. Koepalan ottokohdat paranevat yleensä erinomaisesti, eikä ole syytä pelätä haavan laajenemista (23).
Koepala suositellaan otettavaksi steriilisti paikallispuudutuksessa kapealla veneviillolla sekä haavan reuna-alueelta että haavapohjasta (kts. video Terveyskylän Virtuaalikeskus Haavat → ohjepankki). Haavan reuna-alueelle tai pohjaan voi laittaa esimerkiksi sulavan ompeleen tai haavapohjan voi tyrehdyttää riittävän imevällä sidoksella.
Vaihtoehtoinen tapa on ottaa koepala 5 mm:n stanssilla kahdesta eri kohtaa: haavan reunasta ja haavapohjasta. Haavan reuna-alueelta tarvitaan myös kudosnäyte, koska joskus pahanlaatuisia soluja löytyy vain haavan reunasta (24).
Tarvittaessa koepalan otto tulee uusia, jos koepalan vastaus jää kielteiseksi tai epätarkaksi ja kliininen epäily on selkeä (25). Jos haava ei parane hoidosta huolimatta tai vaikka koepalassa ei löytyisi pahanlaatuisuutta, tulee potilas lähettää erikoissairaanhoitoon lisätutkimuksiin haavan etiologisten syiden selvitykseen.
Levinneisyyden kartoitus ja hoito
Tavallisesti kasvainten aiheuttamien haavojen hoito on keskitetty erikoissairaanhoidon yksiköihin, joiden sivuilta löytyvät yksityiskohtaiset ohjeet levinneisyystutkimuksista ja hoidosta. Kasvainten aiheuttamiin haavoihin liittyviä erikoisaloja ovat mm. plastiikkakirurgia, onkologia, korvataudit, yleiskirurgia sekä ihotaudit (ihokirurgiaan erikoistuneet yksiköt).
Ensisijainen hoito on useimmiten kirurginen. Kasvaimen aiheuttamat haavat ovat diagnoosivaiheessa monesti sen verran kookkaita, että vaaditaan kieleke- tai ihonsiirtoleikkaus. Kliininen terveen kudoksen marginaali vaihtelee kasvaimen lajista ja aggressiivisuudesta riippuen. Joskus hoito voi vaatia myös amputaation (26). Sädehoito tulee kysymykseen erityisesti silloin, kun toteutetaan palliatiivista hoitoa (27).
Basalioomien kohdalla yleensä koko ihon huolellinen tarkistus on riittävä tutkimus, eikä tarkempia radiologisia tutkimuksia tarvita. Ensisijainen hoito on kirurginen, mutta pinnallisen basaliooman ollessa kyseessä voidaan käyttää myös fotodynaamista terapiaa eli PDT-hoitoa (28). Paikallisesti levinneen ja kirurgisen hoidon ulkopuolella olevaa basalioomaa voidaan hoitaa nk. hedgehog-signalointireitin estäjällä (vismodegibi) (29).
Korkean riskin okasolusyövissä harkitaan tapauskohtaisesti kuvantamistutkimuksia (kaikututkimus ja/tai magneetti- tai tietokonekuvaus) tai vartijaimusolmuketutkimuksia ennen kirurgista hoitoa (30). Ca in situ -levyepiteelisyövissä myös PDT-hoito on mahdollinen (28). Levinneissä okasolusyövissä käytetään sädehoitoa ja sisplatiinin ja 5-fluorourasiilin yhdistelmää, johon liitetään usein vielä epidermaalisen kasvutekijän reseptorin (EGFR) estäjä (15).
Melanoomahaavoissa vartijasolmuketutkimusta suositellaan kirurgian yhteydessä sellaisissa tapauksissa, joissa Breslow’n mitta on vähintään 1 mm. Sitä voidaan harkita tapauskohtaisesti myös ohuemmissa melanoomissa, mikäli niissä esiintyy mitooseja tai haavautumista (30,31,32). Paikallisesti edenneessä tai levinneessä melanoomassa voidaan lääkehoitojen lisäksi käyttää hoitona palliatiivista kirurgiaa, sädehoitoa tai isoloitua raajaperfuusiota (33).
Seuranta
Potilaan seuranta määräytyy yksilöllisesti primaarihoidon onnistumisen (riittävät marginaalit) ja kasvaimen tyypin mukaan. Riittävin marginaalein leikatut basalioomat eivät yleensä tarvitse erillistä seurantaa. Okasolusyöpien ja melanoomien seurannan pituus ja tiheys riippuvat kasvaimen TNM-luokituksesta. Erikoissairaanhoidon yksikön tulee antaa näille potilaille selkeät seurantaohjeet ja myös ohjeet siitä, milloin tarvitaan yhteydenottoa.
Avoterveydenhuollossa kontrollien yhteydessä tutkitaan ja tunnustellaan arpialue, tarkistetaan koko iho hiuspohjasta varpaisiin, mukaan lukien genitaalialueet, ja tunnustellaan imusolmukealueet. Erityisesti hoidon jälkeiset kaksi vuotta ovat seurantamielessä tärkeitä, sillä muun muassa okasolusyöpien uusiutumat ilmaantuvat yli 75 %:ssa tapauksista ensimmäisen kahden vuoden aikana (34).
Ennuste
Ennusteeseen vaikuttavat voimakkaasti kasvaimen laji ja se, onko kyseessä primaarinen vai sekundaarinen kasvain. Primaariset basalioomat ja okasolusyövät saadaan yleensä hoidettua kirurgisesti ilman uusiutumista; etenkin jos diagnoosi on ollut oikea-aikainen. Melanoomat, korkean riskin okasolusyövät ja sekundaariset haavauttavat kasvaimet, kuten Marjolinin haava, ovat huonompiennusteisia, koska ne saattavat lähettää jo varhaisvaiheessa etäpesäkkeitä (8). Marjolinin haavapotilailla on raportoitu jopa 37 %:n kuolleisuutta (34).
Lopuksi
Koepala tulisi ottaa jokaisesta haavasta, joka on epätyypillinen tai ei vastaa standardihoitoon 4–12 viikon sisällä. Diagnoosin viivästyminen kasvaimen aiheuttamissa haavoissa voi olla potilaalle kohtalokas.
Avoterveydenhuollossa ongelmaksi voi muodostua se, että haavapotilaat on useimmissa yksiköissä keskitetty hoitajille. Jokaisen haavoja hoitavan yksikön tulisikin laatia selkeät toimintaohjeet siitä, milloin hoitajan tulisi konsultoida lääkäriä haavapotilaan hoidosta. Suosittelemme myös että jokaisella yksiköllä olisi haavahoitajan lisäksi nimetty haavavastuulääkäri, joka toimisi muun muassa koulutusvastaavana ja konsulttina ongelmatilanteissa.
Tätä silmällä pitäen on perustettu Lääkäriliiton haavanhoidon erityispätevyysohjelma, joka on tarkoitettu kaikille haavanhoidosta kiinnostuneille lääkäreille, myös yleislääkäreille avoterveydenhuollossa. Ohjelma sisältää muun muassa kahden vuoden käytännön opiskelun koulutuspaikaksi hyväksytyssä yksikössä, teoreettista koulutusta noin 10 työpäivää sekä kuuden potilastapauksen kirjoittamisen (www.laakariliitto.fi/palvelut/koulutukset/erityispatevyydet/).
Olemme vakuuttuneita, että haavavastuulääkärin ja haavahoitajan työparimalli tuo yksikölle huomattavia kustannussäästöjä, koska potilaiden jatkohoitoon ohjaus tapahtuu nopeammin ja kuormitus haavahoitajan tekemiin interventioihin lyhenee. Samalla potilaan elämänlaatu paranee nopeammalla hoitoon pääsyllä.
Kirsi Isoherranen: Luentopalkkiot (Abbvie, Mediq, Dansac Hollister, Mölnlycke). Heli Lagus, Anne Keinonen, Sari Koskenmies, Leea Ylitalo, Meri Övermark, Sari Pitkänen: Ei sidonnaisuuksia.
- 1
- Posnett J, Gottrup F, Lundgren H, Saal G. The resource impact of wounds on health-care providers in Europe. J Wound Care 2009;18:154–61.
- 2
- Hjort A, Gottrup F. Cost of wound treatment to increase significantly in Denmark over the next decade. J Wound Care 2010;19:173–84.
- 3
- Lindholm C, Searle R. Wound management for the 21st century: combining effectiviness and efficiency. Int Wound J 2016;13:5–15.
- 4
- Vihavainen M, Pylkäs S, Oksanen K. Helsingin kotihoidon haavakartoitus 2015.
- 5
- Mooij MC, Huisman LC. Chronic leg ulcer: does a patient always get a correct diagnosis and adequate treatment? Phlebology 2016;31:68–73.
- 6
- Isoherranen K, Jordan O’Brien J, Barker J ym. EWMA Document. Atypical Wounds. Best clinical practice and challenges. J Wound Care 2019;28(sup 6):S1–92. www.ewma.org/it/resources/for-professionals/ewma-documents-and-joint-publications/
- 7
- Ghasemi F, Anooshirvani N, Sibbald RG, Alavi A. The point prevalence of malignancy in a wound clinic. Int J Low Extrem Wounds 2016;15:58–62.
- 8
- Misciali C, Dika E, Fanti PA ym. Frequency of malignant neoplasms in 257 chronic leg ulcers. Dermatol Surg 2013;6:849–54.
- 9
- Senet P, Combemale P, Debure C ym. Malignancy and chronic leg ulcers: the value of systematic wound biopsies: a prospective, multicenter, cross-sectional study. Arch Dermatol 2012;148:704–8.
- 10
- Maida V, Ennis M, Kuziemsky C, Corban J. Wounds and survival in cancer patients. Eur J Cancer 2009;45:3237–44.
- 11
- Reich-Schupke S, Doerler M, Wollina U ym. Squamous cell carcinomas in chronic venous leg ulcers. Data of the German Marjolin Registry and review. J Dtsch Dermatol Ges 2015;13:1006–13.
- 12
- Janowska A, Oranges T, Chiricozzi A, Romanelli M, Dini V. Synergism of therapies after postoperative autograft failure in a patient with melanoma of the foot misdiagnosed as a pressure ulcer. Wounds 2018;30:E41–3.
- 13
- Jensen P, Hansen S, Møller B ym. Skin cancer in kidney and heart transplant recipients and different long-term immunosuppressive therapy regimens. J Am Acad Dermatol 1999;40:177–86.
- 14
- Lindelöf B, Siguirgeirsson B, Gäbel H, Stern RS. Incidence of skin cancer in 5356 patients following organ transplantation. Br J Dermatol 2000;3:513–9.
- 15
- Que SKT, Zwald FO, Schmults CD. Cutaneous squamous cell carcinoma: incidence, risk factors, diagnosis, and staging. J Am Acad Dermatol 2018;78:237–47.
- 16
- Xiang F, Lucas R, Hales S, Neale R. Incidence of non-melanoma skin cancer in relation to ambient UV radiation in white populations, 1978–2012: empirical relationships. JAMA Dermatol 2014;150:1063–71.
- 17
- E. Copcu. Marjolin’s ulcer: a preventable complication of burns? Plast Reconstr Surg 2009;124:156e–64e.
- 18
- Mantovani A, Perrone F, Stoico V ym. Primary cutaneous B-cell lymphoma and chronic leg ulcers in a patient with type 2 diabetes. Endocrinol Diabetes Metab Case Rep 2017;1:17–32.
- 19
- Da Costa JC. Carcinomatous changes in an area of chronic ulceration, or Marjolin’s ulcer. Ann Surg 1903;37:496–502.
- 20
- Baldursson B, Sigurgeirsson B , Lindelöf B. Venous leg ulcers and squamous cell carcinoma: a large-scale epidemiological study. Br J Dermatol 1995;133:571–4.
- 21
- Patel NP, Kim SH, Padberg FT Jr. Venous ulceration and basal cell carcinoma: coincident or synergistic? J Vasc Surg 2006;44:210.
- 22
- Alavi A, Sibbald RG, Phillips TJ, Miller OF, Margolis DJ. Management of venous leg ulcers: approach to venous leg ulcers. J Am Acad Dermatol 2016;74:627–40.
- 23
- Baraldi C, Sacchelli L, Dika E, Lambertini M. Safety profile of chronic leg ulcer biopsy: a monocentric retrospective series on 866 patients. G Ital Dermatol Venereol 2018. DOI:10.23736/S0392-0488.18.05999-0
- 24
- Enoch S, Miller DR, Price PE, Harding KG. Early diagnosis is vital in the management of squamous cell carcinomas associated with chronic non helaing ulcers: a case series and review of the literature. Int Wound J 2004;1:165–75.
- 25
- Alavi A, Niakosari F, Sibbald RG. When and how to perform a biopsy on a chronic wound. Adv Skin Wound Care 2010;23:132–40.
- 26
- McGarry K, McBride M, Lewis H. Arm amputation secondary to squamous cell carcinoma: exotic expeditions leading to a delayed diagnosis? BMJ Case Rep 2018; 2018:bcr2017223880.
- 27
- Cox, NH, Dyson P. Wound healing on the lower leg after radiotherapy or cryotherapy of Bowen’s disease and other malignant skin lesions. Br J Dermatol 1995;133:60–5.
- 28
- Pitkänen S, Jeskanen L, Ylitalo L. Basalioomat, okasolusyöpä ja sen esiasteet, miten hoidan? Lääketieteellinen Aikakausk Duodecim 2014;130:643–53.
- 29
- Sekulic A, Migden MR, Oro AE ym. Efficacy and safety of vismodegib in advanced basal-cell carcinoma. N Engl J Med 2012;366:2171–9.
- 30
- Navarrete-Dechent C, Veness MJ, Droppelmann N, Uribe P. High-risk cutaneous squamous cell carcinoma and the emerging role of sentinel lymph node biopsy: A Literature review. J Am Acad Dermatol 2015;73:127–37.
- 31
- Koskivuo I, Jahkola T. Primaarimelanooman leikkaushoito. Lääketieteellinen Aikakausk Duodecim 2017;133:1185–91.
- 32
- Juteau S, Kytölä S. Histopatologia ja molekyylipatologia ihomelanooman diagnostiikassa ja hoidon suunnittelussa. Lääketieteellinen Aikakausk Duodecim 2017;133:1220–4.
- 33
- Ilmonen S, Skyttä T, Albäck A. Levinneen ihomelanooman kirurgia, elektrokemoterapia, sädehoito ja isoloitu raajaperfuusio. Lääketieteellinen Aikakauskirja Duodecim 2017;133:1192–8.
- 34
- Schmults CD, Karia PS, Carter JB, Han J, Qureshi AA. Factors predictive of recurrence and death from cutaneous squamous cell carcinoma: a 10-year, single-institution cohort study. JAMA Dermatol 2013;149:541–7.
Malignant wounds
Malignant wounds comprise about 2–4 % of all chronic wounds. Malignant wounds can be subdivided into primary ulcerating skin tumours arising in normal skin and secondary ulcerating skin tumours that develop in chronic ulcers, burn scars or osteomyelitis sinuses. The following signs should raise the suspicion of a malignant wound: atypical ulcer location, excessive granulation tissue, bleeding pigmentation. In addition, if the wound does not show signs of healing within 4–12 weeks with good treatment suspicion of a malignant wound should arise. The most important diagnostic procedure is wound biopsy, and the most common treatment is operative. Prognosis is better in primary ulcerating skin tumours and worse in secondary ulcerating skin tumours.