Munasarjamuutosten diagnostiikka
• Naisten epäselvien vatsaoireiden tai palpaatiolöydösten selvittelyyn kuuluu aina kaikututkimus emättimen kautta.
• Sen perusteella munasarjakasvaimet voidaan yleensä arvioida hyvän- tai pahanlaatuisiksi.
• Kasvainmerkkiaineet tai muut kuvantamistutkimukset eivät ole ensilinjan tutkimuksia munasarjaperäistä kasvainta epäiltäessä. Niillä on merkitystä vasta arvioitaessa kasvainten laatua ja levinneisyyttä.
• Jos munasarjalöydökset ovat hyvänlaatuiset, ei aina tarvita edes seurantaa. Pahanlaatuista kasvainta epäiltäessä hoito kuuluu aina gynekologisen syövän hoitoon perehtyneelle gynekologille yliopistosairaalassa.

Kaikenikäisillä naisilla voi esiintyä hyvin erilaisia munasarjalöydöksiä, jotka vaihtelevat viattomasta toiminnallisesta kystasta aggressiiviseen syöpään. Ne löydetään usein sattumalta kuvantamistutkimuksissa tai tutkittaessa naisen alavatsakipua.
Jopa 85 % kaikista munasarjamuutoksista on hyvänlaatuisia, mutta pahanlaatuisten osuus kasvaa naisen ikääntyessä. Valtaosa munasarjasyövistä löytyy yhä vasta levinneessä vaiheessa, joten varhaisvaiheen diagnostiikkaa pitäisi pystyä parantamaan. Syövän ennusteeseen vaikuttaa eniten riittävän laaja leikkaushoito.
Pääosa munasarjakasvaimista voidaan luokitella kolmeen alatyyppiin, joita ovat epiteliaaliset, sukupienan ja strooman kasvaimet sekä itusolukasvaimet. Kaikissa alatyypeissä on sekä hyvän- että pahanlaatuisiksi luokiteltavia kasvaimia. Suurin osa munasarjakasvaimista on munasarjan pinnasta eli ituepiteelistä peräisin olevia epiteliaalisia kasvaimia. Niitä on arviolta 60 % kaikista munasarjakasvaimista ja jopa 90 % pahanlaatuisista (1).
Maailman terveysjärjestö WHO uudisti munasarjakasvainten luokittelunsa v. 2020. Tavallisimmat epiteliaaliset kasvaimet ovat seroosi, musiini ja endometrioidi kasvain sekä kirkassolukasvain. Hyvän- ja pahanlaatuisten kasvaimien lisäksi on rajalaatuisia kasvaimia (borderline), joiden pahanlaatuisuusaste on vähäisempi (2). Yli 50-vuotiaiden naisten yleisin hyvänlaatuinen munasarjakasvain on seroosi kystadenooma, joka on usein molemminpuolinen (1).
Sukupienan ja strooman kasvaimet ovat peräisin munasarjan stroomasta, joten niille on ominaista hormonaalinen aktiivisuus. Lähtösolunsa mukaisesti ne ovat granuloosa-, teeka-, Sertolin-, Sertolin-Leydigin solu- ja steroidikasvaimia sekä fibroomia, ja niiden osuus on arviolta 8 % kaikista munasarjakasvaimista ja 7 % pahanlaatuisista kasvaimista (1).
Itusolukasvaimet ovat lähtöisin alkuitusoluista, ja kypsiä teratoomia eli dermoidikystia lukuun ottamatta ne ovat harvinaisia ja pahanlaatuisia. Yli puolet lasten ja nuorten munasarjakasvaimista on itusoluperäisiä, ja kolmasosa niistä on pahanlaatuisia. Yleisin munasarjakasvain nuorilla naisilla on kuitenkin dermoidikysta (1).
Osa munasarjoissa todettavista pahanlaatuisista kasvaimista on sekundaarisia, eli muualta peräisin olevan syövän etäpesäkkeitä. Esimerkiksi duktaalinen rintasyöpä, lymfooma ja paksusuolisyöpä voivat olla primaarisia kasvaimia, jotka esiintyvät munasarjoissa etäpesäkkeinä.
Oireet
Munasarjakasvain on usein oireeton. Joskus, esimerkiksi endometrioosissa, se kuitenkin aiheuttaa alavatsakipua, vuotohäiriöitä tai pahenevia kuukautiskipuja. Naisen alavatsakivun selvittämiseen kuuluu olennaisesti gynekologinen tutkimus, johon sisältyy kaikututkimus. Gynekologisen perusanamneesin lisäksi tulee selvittää, onko äidillä tai sisarella ollut munasarja- tai rintasyöpä.
Usein munasarjakasvain voi aiheuttaa paineen tunnetta sekä virtsaamisen ja suolen toiminnan muutoksia. Toisinaan ensimmäinen oire on äkillisesti alkanut kipu kasvaimen puhkeamisen, kiertymän tai verenvuodon takia. Munasarjasyöpää pidetään ns. hiljaisena tappajana, mutta etenkin edetessään se aiheuttaa usein kipuoireiden lisäksi yleisoireita, kuten laihtumista, vatsan turpoamista, ruokahaluttomuutta ja lämpöilyä. Joskus munasarjasyöpä löytyy yskän ja hengenahdistuksen tai laskimoveritulpan taustalta.
Sukupienan ja strooman munasarjakasvaimet aiheuttavat usein oireita hormonitoiminnan aktiivisuuden takia. Granuloosakasvaimien nuoruustyypin muoto aiheuttaa usein ennenaikaisen puberteetin, kun taas aikuistyypin muoto vuotohäiriöitä ja iäkkäillä naisilla postmenopausaalista verenvuotoa (3). Sertolin ja Leydigin soluista peräisin olevat androblastoomat aiheuttavat puolestaan virilisoitumista mieshormonitasojen kasvun takia.
Kaikututkimus
Kun naisella on epämääräisiä vatsavaivoja tai epäillään munasarjakasvainta, on herkästi syytä ohjata hänet emättimen kautta tehtävään gynekologiseen kaikututkimukseen. Kookas munasarjakasvain voi löytyä vasta vatsanpeitteiden päältä tehdyssä kaikututkimuksessa.
Hedelmällisessä iässä olevan naisen normaalit munasarjat ovat halkaisijaltaan noin 3–4 cm ja vaihdevuosi-ikäisellä noin puolta pienemmät. Munasarjamuutoksen koon lisäksi tulisi määritellä kasvaimen rakenne systemaattisesti. Vuonna 1999 kansainvälinen IOTA (International Ovarian Tumor Analysis) -kollegio julkaisi yhtenäiset ohjeet munasarjakasvainten kaikututkimuksissa käytettävistä termeistä ja tutkimustekniikasta (4).
Munasarjakasvaimet jaetaan morfologian mukaan kystisiin, kiinteisiin ja sekakaikuisiin. Yksilokeroiset täysin sileäseinäiset kaiuttomat munasarjakystat ovat käytännössä aina hyvänlaatuisia hedelmällisellä naisella ja yleensä myös vaihdevuosi-iän ylittäneillä. Kiinteät osat ja monilokeroisuus lisäävät kasvaimien pahanlaatuisuuden mahdollisuutta (5).
Pidetään tärkeänä tutkia munasarjakasvaimen verisuonitus doppler-tutkimuksella kaikututkimuksen yhteydessä. Pahanlaatuisissa kasvaimissa lisääntynyt uudisverisuonitus on todettavissa heikon virtausvastuksisen verisuonituksen lisääntymisenä (6). Hyvänlaatuisten munasarjakasvaimien verisuonitus sijaitsee yleensä kasvaimen reunoilla, kun taas verisuonituksen lisääntyminen kasvaimen keskellä tai kiinteissä osissa on yleisempää syöpäkasvaimissa (7) (liitekuva 1, liitekuva 2, liitekuva 3).
Ultraääniluokitukset
Kasvaimien hyvän- ja pahanlaatuisuuden arviointiin on kehitetty erilaisia kaikututkimukseen perustuvia luokitteluja. Jacobs ym. julkaisivat RMI (risk of malignancy index) -luokittelun, jossa kaikulöydöksiin yhdistetään seerumin CA 125 -kasvainmerkkiaineen pitoisuus ja potilaan vaihdevuosivaihe (8). Mitä suurempi pistemäärä, sitä suuremmalla todennäköisyydellä kasvain on pahanlaatuinen. Raja-arvona on pidetty 200:aa, jolla luokituksen sensitiivisyys on ollut tutkimuksissa 78 % ja spesifisyys 87 % (9).
IOTA-kollegio on kehittänyt perusdiagnostiikkaan useita parempia ultraääniluokitteluun perustuvia luokittelumalleja. Logistiset regressiomallit (LR1 ja LR2) ennustavat hyvin kasvaimien pahanlaatuisuutta mutta ovat mutkikkaita käyttää arkityössä (10). Siksi kollegio kehitti kliiniseen käyttöön paremmin soveltuvan ”simple rules” -luokittelun, joka perustuu vain kaikulöydöksiin (taulukko 1).

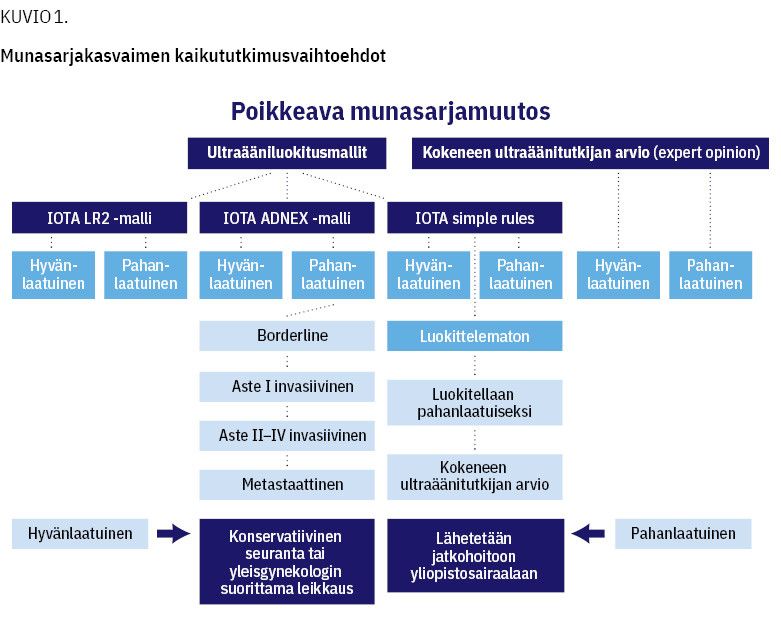
Jos tutkittavassa munasarjakasvaimessa on vain hyvän- tai pahanlaatuisuutta kuvaavia löydöksiä, kasvain luokitellaan sen mukaisesti joko hyvän- tai pahanlaatuiseksi. Muussa tapauksessa kasvain on luokittelematon, jolloin suositellaan kokeneen ultraäänitutkijan tekemää tutkimusta (5). Ryhmän kehittämä munasarjakasvaimien matemaattinen riskiluokittelumalli Adnex (the Assessment of different neoplasias in adnexa) luokittelee pahanlaatuisen kasvaimen tarkemmin löydöksen mukaisesti (11).
Simple rules- ja LR2-luokittelujen on osoitettu olevan sensitiivisyydeltään ja spesifisyydeltään samanarvoisia kuin kokeneen ultraäänitutkijan arvio (expert opinion) kasvaimen hyvän- ja pahanlaatuisuudesta. Parhaimmillaan vain noin 7 % sivuelinlöydöksistä jää asiantuntijan tutkimuksissa luokittelematta (12). Näiden IOTA-mallien sensitiivisyys on 90–95 % ja spesifisyys 74–84 %, kun kokeneen tutkijan arviot ovat vastaavasti 93 % ja 88–89 % (13,14). Käytännön työhön on saatavana ryhmän kehittämiä ultraääniriskimalleja (www.iotagroup.org) tietokoneille ladattavina versioina ja mobiiliapplikaatioina. Malli munasarjakasvainten kaikututkimusten vaihtoehdoista on esitetty kuviossa (kuvio 1).
Kasvainmerkkiaineet
Perinteisesti käytetyin munasarjakasvainmerkkiaine on cancer antigen 125 (CA 125). Sitä käytetään erottamaan munasarjasyöpä hyvänlaatuisista munasarjakasvaimista, syövän hoitovasteen arvioinnissa ja uusiutumisen seurannassa. CA 125 on suurentunut yli 80 %:ssa epiteliaalisista munasarjasyövistä, mutta musiineissa ja alkuvaiheen munasarjasyövissä sen pitoisuus on usein pieni (15).
Kasvainmerkkiaine CA 125 on käyttökelpoisempi postmenopaussi-ikäisillä naisilla kuin hedelmällisessä iässä olevilla. Monet hyvänlaatuiset syyt, kuten raskaus, endometrioosi, myoomat ja lantion tulehdukset voivat suurentaa merkkiaineen pitoisuuksia. Myös munuaisten vajaatoiminta, maksakirroosi ja pankreatiitti sekä rinta-, keuhko- ja mahasuolikanavan syövät voivat aiheuttaa suurentuneita merkkiainepitoisuuksia (15).
CA 125 -merkkiaineen rinnalle on kehitetty HE4 (human epididymis protein 4) -merkkiaine, jota syntyy normaalisti lisääntymiselimissä ja hengitysteissä. HE4-pitoisuudet ovat suurentuneet epiteliaalisessa munasarjasyövässä, etenkin seroosissa ja endometrioidissa alatyypissä, mutta normaalissa munasarjakudoksessa sitä on vain pieniä pitoisuuksia (16). HE4 on osoittautunut vähintään yhtä hyväksi kuin CA 125 munasarjasyövän erotusdiagnostiikassa, mutta erityisesti merkkiaineiden kombinaatio parantaa diagnostiikkaa (17).
Hedelmällisessä iässä olevia naisia hoidettaessa HE4 on erityisen käyttökelpoinen, koska sen pitoisuus ei vaihtele erilaisissa hormonaalisissa tiloissa. Pitoisuuksia kuitenkin suurentavat ikä, tupakointi, munuaisten ja sydämen vajaatoiminta ja mm. kohdunrungon- ja keuhkosyöpä (18).
Seerumin kasvainmerkkiaineita esitetään taulukossa (taulukko 2) (3,19,20,21). Musiiniin munasarjasyöpään ei ole hyviä merkkiaineita.

Muita kuvantamismenetelmiä
Kolmiulotteisen kaikututkimuksen (3D uä) mahdollisuuksista munasarjamuutosten diagnostiikassa julkaistiin tutkimuksia etenkin 2000-luvun alussa. 3D uä -tutkimuksella voidaan tutkia kasvaimen morfologiaa ja sen verenkiertoa. Systemaattisessa katsauksessa todettiin, ettei 3D uä –tutkimus ole kaksiulotteista parempi kasvainten pahanlaatuisuuden arvioinnissa, mutta joissakin epäselvissä tilanteissa siitä saattaa olla hyötyä (22).
Meta-analyysin mukaan magneettikuvauksen ei ole todettu olevan parempi kuin emättimen kautta tehtävä kaksi- ja kolmiulotteinen kaikututkimus munasarjakasvaimien leikkausta edeltävässä arvioinnissa (23). Magneettikuvausta voidaan pitää toisen linjan tutkimuksena vaikeasti luokiteltavien munasarjakasvaimien ja alavatsan alkuperältään epäselvien kasvaimien leikkausta edeltävässä diagnostiikassa (24). Munasarjasyöpää epäiltäessä magneettikuvauksella voidaan selvittää syövän levinneisyyttä, etenkin jos tietokonekerroskuvaus on vasta-aiheinen (25).
Tietokonekerroskuvauksella (TT) on melko huono erottelukyky pehmytkudoksessa, joten ainakin varhaisvaiheen munasarjasyövät voivat jäädä havaitsematta. TT soveltuu hyvin munasarjasyövän levinneisyyden arviointiin ennen leikkausta (25). Positroniemissio-TT (PET-TT) voi olla käyttökelpoinen joissakin tilanteissa levinneisyyden arvioinnissa, mutta primaaridiagnostiikkaan se ei sovellu (25).
Uusia menetelmiä
Runsaasta tutkimustyöstä huolimatta munasarjasyövän varhaisdiagnostiikkaan ei vieläkään ole optimaalista testiä. Lupaavia tuloksia on kuitenkin saatu mm. verenkierron mikro-RNA-tutkimuksista, joissa näitä molekyylejä on tutkittu syövän varhaisina merkkiaineina (26). Tutkimuksissa munasarjasyövän metaboliasta on todettu aineenvaihdunnan muutoksia, joista on etsitty myös merkkiaineita (27). Lipidiaineenvaihdunnan muutoksista on löydettykin uusia lupaavia merkkiaineyhdistelmiä (28).
Lopuksi
Avoterveydenhuollon tehtävänä on osata epäillä munasarjakasvainta oireiden tai tutkimuksen perusteella ja ohjata potilas gynekologiseen kaikututkimukseen. Erilaisten ultraääniluokittelumallien käyttö on kokemuksen tasosta riippuen suotavaa. Merkkiaine- ja lisäkuvantamistutkimukset ovat toissijaisia ja täydentävät tarvittaessa kaikututkimusta, jonka perusteella voidaan yleensä arvioida riittävästi löydöksen hyvän- tai pahanlaatuisuutta. Pahanlaatuisia kasvaimia epäiltäessä potilas tulee viipymättä lähettää yliopistosairaalaan jatkohoidon arvioon.
Liitekuva 1. Seroosi kystadenooma Liitekuva 2. Borderline seroosi kystadenooma Liitekuva 3. Seroosi kystadenokarsinoomaRiikka Niemi: Hallituksen jäsenyys (Gynekologisen kirurgian seura), apurahat (Tampereen Lääkäriseura, Tampereen kaupunki), matka-, majoitus- tai kokouskulut (Olympus Finland).
- 1
- Chen VW, Ruiz B, Killeen JL ym. Pathology and classification of ovarian tumors. Cancer 2003;97:2631–42.
- 2
- Kurman RJ, Carcangiu ML, Herrington CS, Young RH. WHO classification of tumours of female reproductive organs, WHO classification of tumours, 4. painos. Lyon: International Agency for Research on Cancer 2020.
- 3
- Färkkilä A, Unkila-Kallio L. Munasarjan granuloosasolukasvaimen diagnostiikka ja seuranta tarkentuvat. Duodecim 2016;132:1033–9.
- 4
- Timmerman D, Valentin L, Bourne TH ym. Terms, definitions and measurements to describe the sonographic features of adnexal tumors: A consensus opinion from the International Ovarian Tumor Analysis (IOTA) group. Ultrasound Obstet Gynecol 2000;16:500–5.
- 5
- Timmerman D, Testa AC, Bourne T ym. Simple ultrasound-based rules for the diagnosis of ovarian cancer. Ultrasound Obstet Gynecol 2008;31:681–90.
- 6
- Miller RW, Ueland FR. Risk of malignancy in sonographically confirmed ovarian tumors. Clin Obstet Gynecol 2012;55:52–64.
- 7
- Guerriero S, Alcazar JL, Coccia ME ym. Complex pelvic mass as a target of evaluation of vessel distribution by color Doppler sonography for the diagnosis of adnexal malignancies: Results of a multicenter European study. J Ultrasound Med 2002;21:1105–11.
- 8
- Jacobs I, Oram D, Fairbanks J ym. A risk of malignancy index incorporating CA 125, ultrasound and menopausal status for the accurate preoperative diagnosis of ovarian cancer. Br J Obstet Gynaecol 1990;97:922–9.
- 9
- Geomini P, Kruitwagen R, Bremer GL ym. The accuracy of risk scores in predicting ovarian malignancy: A systematic review. Obstet Gynecol 2009;113:384–94.
- 10
- Kaijser J, Bourne T, Valentin L ym. Improving strategies for diagnosing ovarian cancer: A summary of the International Ovarian Tumor Analysis (IOTA) studies. Ultrasound Obstet Gynecol 2013;41:9–20.
- 11
- Van Calster B, Van Hoorde K, Froyman W ym. Practical guidance for applying the Adnex model from the IOTA group to discriminate between different subtypes of adnexal tumors. Facts Views Vis Obgyn 2015;7:32–41.
- 12
- Valentin L, Ameye L, Savelli L ym. Adnexal masses difficult to classify as benign or malignant using subjective assessment of gray-scale and Doppler ultrasound findings: Logistic regression models do not help. Ultrasound Obstet Gynecol 2011;38:456–65.
- 13
- Testa AC, Kaijser J, Wynants L ym. Strategies to diagnose ovarian cancer: New evidence from phase 3 of the multicentre international IOTA study. Br J Cancer 2014;111:680–8.
- 14
- Meys EM, Kaijser J, Kruitwagen RF ym. Subjective assessment versus ultrasound models to diagnose ovarian cancer: A systematic review and meta-analysis. Eur J Cancer 2016;58:17–29.
- 15
- Duffy MJ, Bonfrer JM, Kulpa J ym. CA125 in ovarian cancer: European group on tumor markers guidelines for clinical use. Int J Gynecol Cancer 2005;15:679–91.
- 16
- Hellström I, Raycraft J, Hayden-Ledbetter M ym. The HE4 (WFDC2) protein is a biomarker for ovarian carcinoma. Cancer Res 2003;63:3695–700.
- 17
- Moore RG, Brown AK, Miller MC ym. The use of multiple novel tumor biomarkers for the detection of ovarian carcinoma in patients with a pelvic mass. Gynecol Oncol 2008;108:402–8.
- 18
- Escudero JM, Auge JM, Filella X ym. Comparison of serum human epididymis protein 4 with cancer antigen 125 as a tumor marker in patients with malignant and nonmalignant diseases. Clin Chem 2011;57:1534–44.
- 19
- Brown J, Frumovitz M. Mucinous tumors of the ovary: Current thoughts on diagnosis and management. Curr Oncol Rep 2014;16:389.
- 20
- Al-Hussaini M, Al-Othman Y, Hijazi E, McCluggage WG. A report of ovarian Sertoli-Leydig cell tumors with heterologous intestinal-type glands and alpha fetoprotein elevation and review of the literature. Int J Gynecol Pathol 2017;37:275–83.
- 21
- Goyal LD, Kaur S, Kawatra K. Malignant mixed germ cell tumour of ovary – an unusual combination and review of literature. J Ovarian Res 2014;7:5.
- 22
- Alcazar JL, Jurado M. Three-dimensional ultrasound for assessing women with gynecological cancer: A systematic review. Gynecol Oncol 2011;120:340–6.
- 23
- Dodge JE, Covens AL, Lacchetti C ym. Preoperative identification of a suspicious adnexal mass: A systematic review and meta-analysis. Gynecol Oncol 2012;126:157–66.
- 24
- Forstner R, Thomassin-Naggara I, Cunha TM ym. ESUR recommendations for MR imaging of the sonographically indeterminate adnexal mass: An update. Eur Radiol 2016;27:2248–57.
- 25
- Fischerova D, Burgetova A. Imaging techniques for the evaluation of ovarian cancer. Best Pract Res Clin Obstet Gynaecol 2014;28:697–720.
- 26
- Staicu CE, Predescu DV, Rusu CM ym. Role of microRNAs as Clinical Cancer Biomarkers for Ovarian Cancer: A Short Overview. Cells 2020;9:169.
- 27
- Bonifàcio VDB. Ovarian Cancer Biomarkers: Moving forward in early detection. Adv Exp Med Biol 2020;1219:355–63.
- 28
- Niemi R, Braicu E, Kulbe H ym. Ovarian tumors of different histologic type and clinical stage induce similar changes in lipid metabolism. Br J Cancer 2018;119:847–54.
Assessment of ovarian tumours
Ovarian tumours consist of various neoplasms from innocuous benign cysts to aggressive cancers. Most of the tumours can be categorized as benign or malignant using transvaginal ultrasound. Different ultrasound scoring methods can be used to help in the differential diagnosis and to assist inexperienced ultrasound examiners. Serum biomarkers and other imaging modalities are potentially needed only in specific evaluation of tumours or in preoperative staging of cancers. Early diagnosis of ovarian cancer is still challenging due to lack of clinically used early biomarkers. However, suspicious ovarian malignancies should be referred to university hospitals to be treated by gynaecological oncologists. On the other hand, correct diagnosis of benign ovarian tumours is important so as to avoid unnecessary treatment and operations.
Riikka Niemi
M.D., Ph.D., Specialist in Obstetrics and Gynaecology, Associate Chief Physician
Tampere University Hospital, Department of Obstetrics and Gynaecology