Levinneen munasarjasyövän leikkaushoito
• Munasarjasyöpä todetaan levinneessä vaiheessa suurimmalla osalla potilaista.
• Levinneen munasarjasyövän hoito on leikkaus, jota aina täydennetään solunsalpaajahoidolla. Toimenpide on vaativa, ja siihen liittyy merkittävä komplikaatioiden riski.
• Leikkauksen tavoitteena on kaiken näkyvän kasvaimen poisto.
• Huolellinen suunnittelu, oikea potilasvalinta ja henkilöstön riittävä kokemus ovat leikkauksen välttämättömiä edellytyksiä.

Munasarjasyöpä on Suomessa toiseksi yleisin gynekologinen syöpä ja kymmenenneksi yleisin syöpä naisilla. Siihen sairastuu vuosittain noin 550 naista, ja vuosittainen kuolleisuus on noin 350.
Histologisia alatyyppejä on useita. Tavallisin (65 %) niistä on epiteliaalinen seroosi kasvaintyyppi. Nykykäsityksen mukaan korkean pahanlaatuisuusasteen epiteliaalinen munasarjasyöpä, munatorven syöpä ja vatsakalvolta lähtöisin oleva syöpä, ns. primaari peritoneaalinen karsinoosi muodostavat tautikokonaisuuden, jota kutsutaan korkean pahanlaatuisuusasteen seroosiksi karsinoomaksi (High grade serous carcinoma, HGSC). Näiden kolmen taudin histologia, kliininen kuva, taudin kulku ja hoito ovat samanlaisia. Jos nämä taudit käsitellään yhtenä kokonaisuutena, vuosittainen sairastuvuus on yli 650 ja kuolleisuus noin 450 (1).
Alkuvaiheessaan munasarjasyöpä on oireeton, ja valtaosa (75 %) todetaankin taudin levinneessä vaiheessa. Kasvaimen tavallisin leviämisreitti on vatsakalvolla. Tämä aiheuttaa taudille tyypillisen peritoneaalikarsinoosin, jossa vaihtelevan kokoisia kasvainpesäkkeitä voi olla havaittavissa koko vatsaontelon alueella, lantiosta palleakaariin saakka. Peritoneaalikarsinoosi voi aiheuttaa askitesnesteen kertymistä vatsaonteloon. Tästä seuraa taudin yleisin oire, vatsan turpoaminen (taulukko 1).
Vatsaontelon elinten etäpesäkkeet ovat melko tavallisia. Useimmiten ne sijaitsevat maksassa (8–14 %). Jos munasarjasyöpä leviää vatsaontelon ulkopuolelle, yleisimmät leviämispaikat ovat keuhkopussi ja keuhkot (33–41 %), vatsanpeitteet (41 %) ja imusolmukkeet (19 %) (2,3,4).
Munasarjasyövän hoidon kulmakivi on leikkaus, jonka tavoitteena on kaikkien näkyvien kasvainten poisto. Leikkauksen tulos arvioidaan silmämääräisesti leikkauksen lopuksi. Tavallisesti käytetään luokittelua R0–2, jossa R0 tarkoittaa kaiken näkyvän kasvaimen poistoa, R1 tilannetta, jossa vatsaonteloon jääneen kasvaimen tai kasvainmuutosten koko on alle 1 cm, ja R2 tilannetta, jossa vatsaonteloon jääneen kasvaimen koko on yli 1 cm.
Leikkaustuloksella on yksittäisenä hoidollisena tekijänä suurin merkitys potilaan ennusteeseen. Jos leikkauksessa saadaan poistettua kaikki näkyvä tauti, potilaiden odotettavissa oleva kokonaiselossaoloaika on yli kaksinkertainen verrattuna potilaisiin, joilla on osoitettavissa jäännöskasvainta (mediaani 80 vs. 35 kk, vatsaonteloon rajoittunut kasvain) (5,6,7). Munasarjasyöpä onkin yksi harvoista pahanlaatuisista kasvaimista, joita hoidettaessa voidaan tavoitella jopa parantavaa hoitoa, vaikka kasvain on levinnyt vatsaonteloon. Edellytyksenä on, että näkyvää jäännöskasvainta ei jää.
Munasarjasyövän perinteisessä radikaalileikkauksessa poistetaan gynekologisten elinten lisäksi vatsapaita, umpilisäke, lantion ja vatsa-aortan alueiden imusolmukkeet sekä tarvittaessa paksusuolen loppuosa. Vain pieneltä osalta potilaista pystytään poistamaan kaikki näkyvä kasvainkudos, jos kasvain on levinnyt.
Koska nykyinen tutkimustieto korostaa jäännöskasvaimen merkitystä, potilaan ennusteeseen on pyritty vaikuttamaan leikkauksen laajuutta lisäämällä. Edellä mainittujen toimenpiteiden lisäksi voidaan tehdä muun muassa vatsakalvon poisto kokonaan tai osittain, pernan poisto, useita suolen osapoistoja ja pallealihaksen osan poisto (taulukko 2). Näitä levinneen munasarjasyövän leikkauksia kutsutaan tavallisesti ultraradikaalileikkauksiksi.
Leikkaushoidon käytännöt alkoivat muuttua maailmanlaajuisesti noin vuosituhannen vaihteesta lähtien ja Suomessa 10 viime vuoden aikana. Leikkaushoidon muutoksen vaikutuksesta potilaan ennusteeseen ei kuitenkaan ole satunnaistettua kontrolloitua tutkimusta. Nykyinen sovellettavissa oleva tieto on peräisin retrospektiivisistä analyyseistä, joiden tulokset eivät ole yhtäpitäviä. Tutkimukset kuitenkin suurimmalta osalta viittaavat siihen, että potilaiden ennuste on parantunut, kun leikkauksia on laajennettu (8,9,10,11,12,13).
Levinneen munasarjasyövän hoitoon kuuluu lisäksi solunsalpaajahoito, joka tavallisesti aloitetaan leikkauksen jälkeen. Yleisesti käytetty solunsalpaajahoito on platinapohjainen yhdistelmähoito, tavallisesti paklitakseli yhdistettynä karboplatiiniin. Ensi linjan eli primaarileikkauksen ja liitännäissolunsalpaajahoidon sijaan hoito voidaan tietyissä tilanteissa aloittaa solunsalpaajahoidolla (neoadjuvanttihoito). Silloin leikkaus tehdään tavallisimmin kolmen hoitokerran jälkeen (intervallileikkaus). Jos potilas toipuu normaalisti, solunsalpaajahoito jatkuu leikkauksen jälkeen.
Leikkauksen suunnittelu
Potilaan leikkaushoidon suunnitteluun vaikuttavat taudin levinneisyys, potilaan perussairaudet ja yleistila, elintavat, lääkitys, ravitsemustila, ikä ja toimintakyky. Taudin levinneisyys arvioidaan vartalon tietokonekerroskuvauksella. Tarkentavina tutkimuksina voidaan tarvittaessa käyttää magneettikuvausta ja positroniemissiotomografiaa (Pet-TT).
Leikkaushoidon suunnittelun tarkoituksena on kohdentaa resursseja oikeille potilaille. Riskialttiita ja laajoja toimenpiteitä ei tulisi tehdä potilaille, joilla leikkaustulos jäisi toimenpiteistä huolimatta puutteelliseksi, eli jäännöskasvaimen koko olisi yli 1 cm (R2). Näillä potilailla leikkaus joka tapauksessa vaikuttaisi taudin kulkuun vain vähän.
Käytännössä leikkaustuloksen arviointi etukäteen on kuitenkin haastavaa. Yksi tähän käytetty menetelmä on vatsaontelon tähystysleikkaus eli diagnostinen laparoskopia ennen varsinaista leikkausta (14). Vaikka sen osuvuus leikkaustuloksen ennustamisessa on tutkimuksissa ollut melko hyvä, diagnostinen laparoskopia ei kuitenkaan ole vakiintunut yleiseen käyttöön kaikissa munasarjasyöpää hoitavissa yksiköissä. Koska munasarjasyöpä leviää koko vatsaontelon alueella, leikkaustuloksen kannalta kriittisiä kasvainpesäkkeitä voi sijaita paikoissa, joita on mahdotonta tarkastella tähystysmenetelmällä. Myös nykyisten kuvantamistutkimusten soveltuvuus leikkaustuloksen ennustamiseen on rajallinen. Puutteellisen leikkaustuloksen yleisin syy on kasvaimen laaja, epätarkkarajainen leviäminen ohutsuolen suoliliepeeseen. Tämä ei välttämättä näy kuvantamistutkimuksissa (15).
Koska levinneen munasarjasyövän hoito vaatii aina myös solunsalpaajahoidon, leikkaus tulee toteuttaa siten, että potilas toipuu siitä riittävän hyväkuntoiseksi. Leikkauksiin ja erityisesti syöpäleikkauksiin liittyy aina komplikaatioiden riski, ja vaikka leikkauksella saavutettaisiin haluttu tavoite, potilaan ennuste on joka tapauksessa huono, jos solunsalpaajahoitoa ei voida toteuttaa komplikaatioiden takia (16). Jos leikkauskomplikaatioiden riski on merkittävästi suurentunut esimerkiksi potilaan perussairauksien tai huonon ravitsemustilanteen takia, on perusteltua aloittaa hoito ensi linjan leikkauksen sijaan neoadjuvanttisolunsalpaajahoidolla.
Tutkimuksissa on osoitettu, että ennen leikkausta aloitettu solunsalpaajahoito ja intervallileikkaus vähentävät komplikaatioriskiä. Kokonaiselossaoloajassa ei sen sijaan ole samalla havaittu eroa verrattuna ensilinjan leikkaukseen ja sitä seuraavaan solunsalpaajahoitoon (17,18,19). Siksi neoadjuvanttihoito ja intervallileikkaus ovat ensisijainen valinta monissa munasarjasyöpää hoitavissa keskuksissa Euroopassa, erityisesti jos kasvainta arvioidaan olevan potilaan vatsaontelossa runsaasti.
Osaa tutkimuksista on kuitenkin kritisoitu vaatimattomien leikkaustulosten takia. Kasvain saatiin täydellisesti poistetuksi (R0) vain vajaassa viidesosassa ensilinjan leikkauksista, eikä tulos täytä nykyisiä levinneen munasarjasyövän leikkaustoiminnan laatukriteerejä (17,19,20). Retrospektiivisten aineistojen perusteella on myös arvioitu, että potilaiden kokonaiselossaoloaika voi olla lyhyempi intervallileikkauksen jälkeen kuin potilailla, joille tehdään ensilinjan leikkaus (21). Levinneen munasarjasyövän hoidossa pyritään Suomessa yleensä ensilinjan leikkaukseen, jos se vain on mahdollista potilaan kokonaistilanne huomioon ottaen.
Potilaan hoitosuunnitelma tehdään moniammatillisessa hoitokokouksessa. Siinä päätetään käytettävissä olevien kuvantamistutkimusten tulosten ja potilaan kokonaistilanteen arvioinnin perusteella muun muassa leikkaushoidon ja solunsalpaajahoidon keskinäinen järjestys ja tehdään suositus käytettävästä solunsalpaajahoidosta. Leikkauksen suunnittelee ja toteuttaa gynekologinen onkologi. Yhteistyö anestesialääkärin ja suolikirurgin kanssa jo leikkauksen suunnitteluvaiheessa on kuitenkin hyvän lopputuloksen kannalta välttämätöntä.
Huolellisen suunnittelun tavoitteena on ennakoida ja estää ongelmat leikkauksen jälkeen. Potilaalle kokonaistilanteen arvioinnin jälkeen laadittu hoitosuunnitelma saattaa joskus tarkoittaa myös laajasta leikkauksesta pidättäytymistä.
Levinneen munasarjasyövän leikkauksen vasta-aiheista ei ole yleisesti hyväksyttyjä suosituksia. Leikkauksen jälkeistä sairastavuutta ja kuolleisuutta ovat tutkimuksissa lisänneet yli 80 vuoden ikä ja seerumin pieni albumiinipitoisuus, joka on yksi vajaaravitsemuksen merkkiaine (22,23). Vaikka näitä potilaita päädyttäisiinkin hoitamaan leikkauksella, sen laajuudesta voidaan joutua tinkimään, jotta solunsalpaajahoitoa viivyttäviltä tai sen kokonaan estäviltä komplikaatioilta vältyttäisiin. Muita leikkauksen suhteellisia vasta-aiheita ovat American Society of Anesthesiologists (Asa) -luokka kolme tai enemmän ja syöpäpotilaiden toimintakykyä kuvaava WHO:n Zubrod-luokka kaksi tai enemmän (24,25).
Leikkausvalmistelut
Potilas valmistellaan leikkausta varten noudattaen optimoidun toipumisen periaatteita (Enhanced recovery pathway, ns. Fast track-kirurgia) (26). Tavoitteena on saada potilaan yleistila mahdollisimman hyväksi, jolloin leikkauksen jälkeisten komplikaatioiden riski pienenee.
Levinnyttä munasarjasyöpää sairastavilla naisilla kertyy vatsaonteloon askitesnestettä. Tämä voi aiheuttaa vatsan turvotusta, pahoinvointia ja ruokahaluttomuutta ja johtaa hitaasti kehittyvään vajaaravitsemustilaan.
Potilaan yleisvointi korjaantuu ravitsemusta parantamalla suhteellisen hitaasti, eikä leikkausta edeltävä ajanjakso välttämättä riitä siihen. Ravitsemusta tulisi kuitenkin pyrkiä parantamaan ohjeistamalla potilaita käyttämään tarvittaessa lisäravintovalmisteita. Ravitsemuksellisena toimenpiteenä tehdään lisäksi hiilihydraattitankkaus ennen leikkausta.
Ennen leikkausta todettu anemia suurentaa myös komplikaatioriskiä. Anemian syynä on yleensä raudanpuute, jonka hoitona voidaan käyttää suun kautta tai suonensisäisesti annosteltua rautaa. Jos potilaan hemoglobiinipitoisuus saadaan korjatuksi ennen leikkausta, verensiirtojen tai erytropoieesia stimuloivien lääkkeiden tarve vähenee. Koholla oleva verensokeri on syytä huomioida ja mahdollisuuksien mukaan hoitaa. Leikkausajankohtaa ei kuitenkaan ole syytä siirtää normaalin sokeritasapainon saavuttamiseksi. Tupakoinnin ja alkoholin käytön lopettaminen riittävän ajoissa ennen leikkausta on tärkeää, ja potilasta tulee motivoida tähän painokkaasti.
Leikkausta edeltäviin valmisteluihin sisältyy lisäksi varautuminen mahdolliseen suoliavanteeseen ja avannehoitajan tapaaminen. Suolen tyhjennyksen suhteen käytännöt vaihtelevat. Sitä ei yleisesti suositella fast track -kirurgiassa, mutta jos leikkauksessa tehdään matala peräsuolen sauma, suolen tyhjennyksestä voi olla hyötyä (27).
Levinneen munasarjasyövän leikkauksessa peräsuolen osapoisto ja peräsuolen sauma ovat tavallisia toimenpiteitä. Siksi esimerkiksi Taysissa leikkausta edeltävään protokollaan kuuluu kevennetty suolen tyhjennys natriumpikosulfaatilla, kahden litran nestemäärällä ja peräruiskeella.
Leikkauksen toteuttaminen
Levinneen munasarjasyövän leikkaus on avoleikkaus. Tähystysleikkausmenetelmää käytetään muussa gynekologisessa syöpäkirurgiassa, ja sen edut siinä ovat kiistattomat. Levinneen munasarjasyövän hoitoon tähystysleikkausmenetelmä ei kuitenkaan sovellu, koska tarkoituksena on poistaa kasvainta usealta eri alueelta vatsaontelosta.
Avoleikkauksen alussa tehdään huolellinen koko vatsaontelon kattava arviointi, jossa huomioidaan kasvainmuutosten sijainti leikkaustuloksen kannalta olennaisilla alueilla. Tämän arvion perusteella tehdään päätös, miten toimenpiteessä edetään. Käytännössä tämä tarkoittaa sitä, että leikkausta ei ole syytä jatkaa, jos laajoista toimenpiteistä huolimatta vatsaonteloon jäävien kasvainmuutosten koko on suurempi kuin 1 cm. Oireita lievittävänä toimenpiteenä voidaan kookkaita kasvainmuutoksia kuitenkin poistaa, jos siitä ei aiheudu komplikaatioriskin merkittävää kasvua.
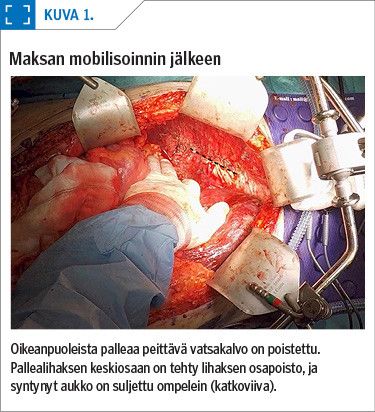
Huomattava osa leikkauksesta on ylävatsakirurgiaa, joten riskit ovat suuremmat kuin muussa gynekologisessa syöpäkirurgiassa. Palleakaarten vatsakalvolle tai pallealihakseen levinneen kasvaimen poisto vaatii aluksi maksan mobilisoinnin. Siinä maksan kannatinligamentit irrotetaan ja tavallisimmin oikea lohko siirretään syrjään. Mobilisointiin liittyy massiivisen verenvuodon riski (kuva 1).
Ohutsuolen suoliliepeen ohella leikkaustuloksen kannalta olennaisia rakenteita ovat porttilaskimo, maksavaltimo, yhteinen sappitiehyt ja sisusvaltimorunko (28). Näiden rakenteiden lähellä olevien kasvainmuutosten poisto vaatii leikkaavalta lääkäriltä kokemusta. Tavallisimmat vatsaontelon ulkopuoliset etäpesäkkeet ovat sydän-palleakulman imusolmukkeissa, joiden poisto on mahdollista palleaan tehdyn avauksen kautta. Kirurgisten toimenpiteiden hyödystä vatsaontelon ulkopuolella ei kuitenkaan ole tutkimusnäyttöä, joten niihin tulee suhtautua varauksella (29).
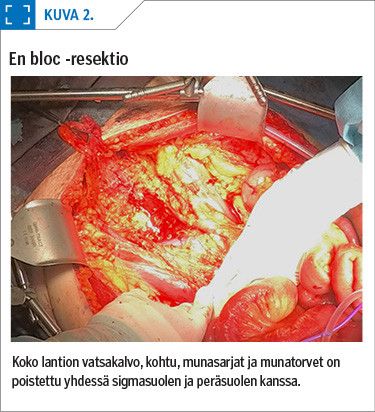
Kohtu, munasarjat ja -torvet poistetaan tavallisesti yhdessä peräsuolen ja sigmasuolen kanssa, ns. en bloc -resektiona. Perä- ja sigmasuolen osapoisto tehdään arviolta yli puolessa leikkauksista (30). Kudosten rajoja ei usein voi tunnistaa, koska kasvain on levinnyt koko lantion alueelle. Siksi leikkauksessa edetään vatsakalvon takaisessa tilassa, joka on yleensä anatomialtaan säilynyt (kuva 2). Suolen osapoiston jälkeen pyritään ensisijaisesti tekemään suolisauma, mutta myös suoliavanne on mahdollinen, jos tilanne sitä edellyttää.
Välittömän seurannan järjestelyt leikkauksen jälkeen tulee suunnitella etukäteen. Koska toimenpiteitä on useita ja leikkausaika on pitkä, verenpaineen lääkkeellisen tuen tarve, happo-emästasapainon häiriöt sekä nestehoidon ongelmat ovat yleisiä haasteita leikkauksen jälkeen. Seuranta teho-osastolla leikkauksen jälkeen on siksi perusteltua, mutta käytännöt vaihtelevat.
Hoito leikkauksen jälkeen ja komplikaatiot
Leikkauksen jälkeen hoidon tavoitteena on potilaan kuntouttaminen, komplikaatioiden tunnistaminen, riittävä kivunhoito, ravitsemuksen varmistaminen ja psyykkinen tukeminen. Fysioterapeutin arvio ja ohjaus on tarpeen liikkumisen aloittamisen tukemisessa. Jos potilaan vointi sallii, jalkeille ja liikkeelle tulisi pyrkiä heti leikkausta seuraavana päivänä.
Ravitsemus aloitetaan suun kautta mahdollisimman nopeasti, mutta syömisen aloittaminen voi olla vaikeaa varsinkin, jos suolen osapoistoja on tehty useita. Suonensisäistä ravitsemusta käytetään kuitenkin vain poikkeustapauksissa, käytännössä vain, jos syömisen aloittaminen pitkittyy yli viikon (31).
Komplikaatioriski leikkauksen jälkeen on merkittävä, noin 26–50 % (18,32,33,34). Yleisimpiä komplikaatioita ovat leikkausalueen infektiot, joista osa voi olla septisiä (taulukko 3). Infektioiden hoitona riittää useimmiten antibiootti, mutta tulehduspesäkkeen tyhjennys kuvantamisohjauksessa voi olla tarpeen, jos lääkehoito ei tehoa.
Suolisauman vuoto voi aiheuttaa erityisen vaikean infektion, jolloin tilanne vaatii sauman korjauksen päivystysleikkauksessa. Usein seurauksena on myös suoliavanne. Arviot yksittäisiin toimenpiteisiin liittyvästä komplikaatioiden riskistä vaihtelevat, mutta suurin riski vaikuttaisi liittyvän suolen osapoistoon (52 %), pallealihaksen osapoistoon (13–39 %), haiman hännän osapoistoon (25 %) ja maksan osapoistoon (23 %) (32,35,36,37).
Leikkauksen jälkeen sekä vatsaonteloon että keuhkopusseihin kertyy nestettä. Keuhkopussiin kerääntyvä neste voi aiheuttaa hengenahdistusta ja jopa hengitysvajauksen. Jos leikkauksen yhteydessä ei ole asetettu erillistä dreeniä, neste poistetaan keuhkopussin pistolla.
Levinneen munasarjasyövän leikkauksen vaikutuksesta potilaan elämänlaatuun on vain vähän tutkimustietoa. Leikkaus heikentää potilaan elämänlaatua merkittävästi mutta ei pysyvästi. Noin puolen vuoden kuluttua leikkauksesta elämänlaatu ja toimintakyky on palautunut vähintään leikkausta edeltävälle tasolle (33,38). On kuitenkin huomattava, että suurin osa potilaista on oireisia ennen leikkausta, eli elämänlaadun lähtötaso on monilla jo heikentynyt.
Lopuksi
Huolellinen suunnittelu ja oikea potilasvalinta ovat levinneen munasarjasyövän leikkauksen ja sitä seuraavan solunsalpaajahoidon onnistumisen keskeisiä edellytyksiä. Lähivuosina on odotettavissa tuloksia Trust-monikeskustutkimuksesta, jonka tavoitteena on selvittää ensilinjan leikkauksen hyöty verrattuna neoadjuvanttihoitoon ja intervallileikkaukseen.
Tutkimus toteutetaan keskuksissa, joiden leikkaustoiminnan laatu on varmistettu ennalta määrätyillä kriteereillä. Näin pyritään varmistamaan, että aikaisempiin vastaaviin tutkimuksiin liittyneet epävarmuudet eivät toistu ja tutkimuksen tulokset olisivat paremmin sovellettavissa käytäntöön (39).
Myös lääkehoito kehittyy jatkuvasti, ja munasarjasyövän hoidossa käytetyt uudet täsmälääkkeet, poly-ADP-riboosipolymeraasientsyymin (Parp) estäjät, parantavatkin osalla potilaista taudin ennustetta huomattavasti (40). Tästä huolimatta kasvaimen täydellisen poiston merkitys on vastedeskin suuri, joten leikkaushoitoon liittyvät haasteet eivät katoa.
Kiitokset dosentti Synnöve Staffille käsikirjoituksen kriittisestä arvioinnista ja arvokkaista kommenteista.
Sami Saarelainen: Matka-, majoitus- tai kokouskulut (GSK, Astra Zeneca).
- 1
- Pitkäniemi J, Malila N, Virtanen A, Degerlund H, Heikkinen S, Seppä K. Syöpä 2018. Tilastoraportti Suomen syöpätilanteesta. Suomen Syöpäyhdistyksen julkaisuja nro 93. Suomen Syöpäyhdistys, Helsinki 2020.
- 2
- Hussain I, Xu J, Deng K ym. The prevalence and associated factors for liver metastases, development and prognosis in newly diagnosed epithelial ovarian cancer: A large population-based study from the Seer database. J Cancer 2020;11:4861–9.
- 3
- Ataseven B, Grimm C, Harter P ym. Prognostic impact of debulking surgery and residual tumor in patients with epithelial ovarian cancer FIGO stage IV. Gynecol Oncol 2016;140:215–20.
- 4
- Deng K, Yang C, Tan Q ym. Sites of distant metastases and overall survival in ovarian cancer: A study of 1481 patients. Gynecol Oncol 2018;150:460–5.
- 5
- du Bois A, Reuss A, Pujade-Lauraine E, Harter P, Ray-Coquard I, Pfisterer J. Role of surgical outcome as prognostic factor in advanced epithelial ovarian cancer: A combined exploratory analysis of 3 prospectively randomized phase 3 multicenter trials. Cancer 2009;115:1234–44.
- 6
- Winter WE, Maxwell GL, Tian C ym. Tumor residual after surgical cytoreduction in prediction of clinical outcome in stage IV epithelial ovarian cancer: A Gynecologic Oncology Group Study. J Clin Oncol 2008;26:83–9.
- 7
- Wimberger P, Wehling M, Lehmann N ym. Influence of residual tumor on outcome in ovarian cancer patients with Figo stage IV disease. Ann Surg Oncol 2010;17:1642–8.
- 8
- Harter P, Muallem Z, Buhrmann C ym. Impact of a structured quality management program on surgical outcome in primary advanced ovarian cancer. Gynecol Oncol 2011;121:615–9.
- 9
- Lim M, Yoo H, Song Y ym. Survival outcomes after extensive cytoreductive surgery and selective neoadjuvant chemotherapy according to institutional criteria in bulky stage IIIC and IV epithelial ovarian cancer. J Gynecol Oncol 2017;28:e48.
- 10
- Raspagliesi F, Bogani G, Ditto A ym. Implementation of extensive cytoreduction resulted in improved survival outcomes for patients with newly diagnosed advanced-stage ovarian, tubal, and peritoneal cancers. Ann Surg Oncol 2017;24:3396–405.
- 11
- Falconer H, Joneborg U, Krawiec K, Palsdottir K, Bottai M, Salehi S. Ultra-radical upfront surgery does not improve survival in women with advanced epithelial ovarian cancer; a natural experiment in a complete population. Gynecol Oncol 2020;159:58–65.
- 12
- Martinez A, Ngo C, LeBlanc E ym. Surgical complexity impact on survival after complete cytoreductive surgery for advanced ovarian cancer. Ann Surg Oncol 2016;23:2515–21.
- 13
- Dahm-Kähler P, Palmqvist C, Staf C, Holmberg E, Johannesson L. Centralized primary care of advanced ovarian cancer improves complete cytoreduction and survival – A population-based cohort study. Gynecol Oncol 2016;142:211–6.
- 14
- Fagotti A, Ferrandina G, Fanfani F ym. A laparoscopy-based score to predict surgical outcome in patients with advanced ovarian carcinoma: a pilot study. Ann Surg Oncol 2006;13:1156–61.
- 15
- Heitz F, Harter P, Alesina P ym. Pattern of and reason for postoperative residual disease in patients with advanced ovarian cancer following upfront radical debulking surgery. Gynecol Oncol 2016;141:264–70.
- 16
- Starbuck K, Szender J, Duncan W ym. Prognostic impact of adjuvant chemotherapy treatment intensity for ovarian cancer. PloS one 2018;13(11), p.e0206913.
- 17
- Vergote I, Tropé C, Amant F ym. Neoadjuvant chemotherapy or primary surgery in stage IIIC or IV ovarian cancer. N Engl J Med 2010;363:943–53.
- 18
- Fagotti A, Ferrandina M, Vizzielli G ym. Randomized trial of primary debulking surgery versus neoadjuvant chemotherapy for advanced epithelial ovarian cancer (Scorpion-NCT01461850). Int J Gynecol Cancer 2020;30:1657–64.
- 19
- Kehoe S, Hook J, Nankivell M ym. Primary chemotherapy versus primary surgery for newly diagnosed advanced ovarian cancer (Chorus): an open-label, randomised, controlled, non-inferiority trial. Lancet 2015;386:249–57.
- 20
- Fotopoulou C, Concin N, Planchamp F ym. Quality indicators for advanced ovarian cancer surgery from the European Society of Gynaecological Oncology (Esgo): 2020 update. Int J Gynecol Cancer 2020;30:436–40.
- 21
- Bristow R, Chi D. Platinum-based neoadjuvant chemotherapy and interval surgical cytoreduction for advanced ovarian cancer: a meta- analysis. Gynecol Oncol 2006;103:1070–6.
- 22
- Mahdi H, Wiechert A, Lockhart D, Rose P. Impact of age on 30-day mortality and morbidity in patients undergoing surgery for ovarian cancer. Int J Gynecol Cancer 2015;25:1216–23.
- 23
- Ataseven B, du Bois A, Reinthaller A ym. Pre-operative serum albumin is associated with post-operative complication rate and overall survival in patients with epithelial ovarian cancer undergoing cytoreductive surgery. Gynecol Oncol 2015;138:560–5.
- 24
- Saklad M. Grading of patients for surgical procedures. Anesthesiology 1941;2:281–4.
- 25
- Oken M, Creech R, Tormey D ym. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982;5:649–55.
- 26
- Nelson G, Altman A, Nick A ym. Guidelines for pre- and intra-operative care in gynecologic/oncology surgery: Enhanced Recovery After Surgery (ERAS®) Society recommendations – Part I. Gynecol Oncol 2016;140:313–22.
- 27
- Bretagnol F, Panis Y, Rullier E ym. Rectal cancer surgery with or without bowel preparation: The French Greccar III multicenter single-blinded randomized trial. Ann Surg 2010;252:863–8.
- 28
- Gallotta V, Ferrandina G, Vizzielli G ym. Hepatoceliac lymph node involvement in advanced ovarian cancer patients: prognostic role and clinical considerations. Ann Surg Oncol 2017;24:3413–21.
- 29
- Prader S, Vollmar N, du Bois A ym. Pattern and impact of metastatic cardiophrenic lymph nodes in advanced epithelial ovarian cancer. Gynecol Oncol 2019;152:76–81.
- 30
- Grimm C, Harter P, Alesina P ym. The impact of type and number of bowel resections on anastomotic leakage risk in advanced ovarian cancer surgery. Gynecol Oncol 2017;146:498–503.
- 31
- Braga M, Ljunqvist O, Soeters P, Fearon K, Weimann A, Bozzetti F. Espen guidelines on parenteral nutrition: Surgery. Clinical Nutrition 2009;28:378–86.
- 32
- Xu Z, Becerra A, Justiniano C ym. Complications and survivorship trends after primary debulking surgery for ovarian cancer. J Surg Res 2020;246:34–41.
- 33
- Fagotti A, Ferrandina G, Vizzielli G ym. Phase III randomised clinical trial comparing primary surgery versus neoadjuvant chemotherapy in advanced epithelial ovarian cancer with high tumour load (Scorpion trial): Final analysis of peri-operative outcome. Eur J Cancer 2016;59:22–33.
- 34
- Rafii A, Stoeckle E, Jean-Laurent M ym. Multi-center evaluation of post-operative morbidity and mortality after optimal cytoreductive surgery for advanced ovarian cancer. PloS one 2012;7:e39415–e39415.
- 35
- Di Donato V, Bardhi E, Tramontano L ym. Management of morbidity associated with pancreatic resection during cytoreductive surgery for epithelial ovarian cancer: A systematic review. Eur J Surg Oncol 2020;46:694–702.
- 36
- Benedetti Panici P, Di Donato V, Fischetti M ym. Predictors of postoperative morbidity after cytoreduction for advanced ovarian cancer: Analysis and management of complications in upper abdominal surgery. Gynecol Oncol 2015;137:406–11.
- 37
- Merideth M, Cliby W, Keeney G, Lesnick T, Nagorney D, Podratz K. Hepatic resection for metachronous metastases from ovarian carcinoma. Gynecol Oncol 2003;89:16–21.
- 38
- Soo Hoo S, Marriott N, Houlton A ym. Patient-reported outcomes after extensive (ultraradical) surgery for ovarian cancer: results from a prospective longitudinal feasibility study. Int J Gynecol Cancer 2015;25:1599–607.
- 39
- Reuss A, du Bois A, Harter P ym. Trust: Trial of radical upfront surgical therapy in advanced ovarian cancer (Engot OV33/Ago-Ovar OP7). Int J Gynecol Cancer 2019;29:1327–31.
- 40
- Tew W, Lacchetti C, Ellis A ym. Parp inhibitors in the management of ovarian cancer: Asco guideline. J Clin Oncol 2020;38:3468–93.
Surgical treatment of advanced ovarian cancer
Ovarian cancer is commonly diagnosed at an advanced stage and its clinical manifestation, peritoneal carcinomatosis, presents a major surgical challenge. The outcome of the cytoreductive surgery is the most important factor influencing the survival of patients with advanced ovarian cancer. The objective of the operation is complete removal of all visible tumour, i.e. complete resection. This can be achieved upfront by primary debulking surgery, or, following neoadjuvant chemotherapy, by interval debulking surgery. The major part of the operation for advanced ovarian cancer is upper abdominal surgery, as metastases are often seen in the liver, spleen and peritoneal surface of the diaphragm.
Extensive surgery has a high risk for complications. Evaluation of risks and execution of risk-reducing measures according to enhanced recovery pathway protocols are of paramount importance in the preoperative workup. In spite of these actions, postoperative complications are seen, of which infections and pleural effusions are among the most common.
Postoperative treatment consists of physical rehabilitation, nutritional assistance and psychological support. Efficient pain control is important to ensure recovery. The patients´ quality of life deteriorates temporarily to a great extent, but gradually returns to baseline by six months after surgery.