Lapsen sepsis – Epäile, tunnista elinhäiriöt ja aloita hoito
Sepsis on oireyhtymä, jossa infektion laukaisema tulehdusvaste aiheuttaa elinhäiriöitä.
Septisessä sokissa on nestehoidosta huolimatta verenkiertovajaus ja tarvitaan verenkierron tukilääkitystä.
Kun lapsella on infektioon sopivia oireita tai hän on selittämättömästi sairas, on sepsis aina otettava huomioon. Sen systemaattista seulontaa ja hoitoprotokollaa suositellaan lapsia hoitaville päivystyspoliklinikoille.
Ennuste paranee, kun mikrobilääkehoito aloitetaan sepsiksessä kolmen tunnin ja sokissa tunnin kuluessa.
Septinen lapsi kuuluu yksikköön, jossa on mahdollisuus tehohoitoon.

Sepsiksessä epäilty tai todettu infektio ja tulehdusvaste aiheuttavat eri elinjärjestelmien toimintahäiriöitä, elinhäiriöitä (1,2). Septisessä sokissa vallitsee infektion ja immuunivasteen seurauksena ja nestehoidosta huolimatta verenkiertovajaus, jossa tarvitaan verenkierron tukilääkitystä kudosten verenkierron turvaamiseksi (2).
Sepsiksen ja septisten elinhäiriöiden mekanismeja ei tunneta kokonaan, mutta bakteeri- tai virusinfektion laukaisemalla epätarkoituksenmukaisella immuunivasteella on merkittävä osuus sepsikseen sairastumisessa ja taudin vaikeusasteessa. Infektion laukaisemaan vasteeseen vaikuttavat taudinaiheuttajan lisäksi ikä, sukupuoli, perussairaudet, ympäristö sekä geneettiset ja epigeneettiset tekijät (3,4).
Siten sepsiksessä ei ole kyse "pahaksi päässeestä" infektiosta eikä aina bakteeritaudistakaan. Sen sijaan sepsis on itsenäinen oireyhtymä, jossa elinhäiriöihin johtava taudinkuva käynnistyy jo varhaisessa vaiheessa. Elinhäiriöiden etsiminen infektiopotilaalta on välttämätöntä sepsiksen tunnistamiseksi ja mielekästä myös siksi, että elinhäiriöt lisäävät kuolleisuutta (5).
Vuosittain noin 50 miljoonaa ihmistä sairastuu sepsikseen, ja siitä johtuu viidesosa maailman kuolemista (6). Sairastuneista puolet on lapsia (6), joten sepsis on myös lastentauti. Siihen sairastuneen lapsen kuolemanriski on noin 5–6 %, ja septisessä sokissa noin 10–20 % (7). Neljäsosalle selviytyjistä jää pysyvä vamma (8). Jos tehohoitoon ei ole mahdollisuutta, kuolleisuus on jopa 50 % (9).
Lähes puolella sepsikseen sairastuneista lapsista on riskitekijöitä, kuten krooninen keuhkosairaus, synnynnäinen sydänvika, syöpä tai lihasheikkoutta aiheuttava sairaus (10). Siihen voivat kuitenkin sairastua ja kuolla myös aiemmin terveet lapset. Vastasyntyneillä sepsisriski on suuri. Erilaisen taudinkuvan ja hoidon järjestelyn vuoksi tässä katsauksessa ei kuitenkaan käsitellä alle 28 vrk:n ikäisen lapsen sepsistä.
Elinhäiriöt avainasemassa lapsillakin
Lasten sepsiksen määritelmää on tarkennettu v. 2020 mukailemaan sepsiksen yleistä määritelmää (2,11). Lapsella on sepsis, kun hänellä on todennäköinen infektio ja elinhäiriö tai elinhäiriöitä. Septisestä sokista on kyse, kun lapsella on sepsikseen liittyvä verenkiertovajaus ja kudosverenkierto on heikentynyt (kudoshypoperfuusio) aloitetusta nestehoidosta huolimatta, niin että lapsi tarvitsee verenkierron tukilääkitystä riittävän verenkierron turvaamiseksi.
Inflammaatiovastetta luokittelevia, ns. SIRS-kriteereitä (12) ei enää käytetä (2). Lapsen septiset elinhäiriöt voidaan luokitella vuoden 2005 kriteerien tai PELOD (Pediatric Logistic Organ Dysfunction) -kriteerien perusteella (12,13,14) (taulukko 1).
Seulo systemaattisesti ja etsi elinhäiriöitä
Päivystysvastaanotoilla on paljon kuumeisia lapsia. Suurimmalla osalla heistä ei ole sepsistä. Useimmiten kyseessä on vaaraton virustauti ja joskus pneumonian tai pyelonefriitin kaltainen ei-septinen, mutta hoitoa vaativa vaikea infektio (15,16).
Tavoitteena on poimia ja ohjata kiireellisemmin lääkärin arvioon potilaat, joiden sepsisriski on suurentunut. Valmiita seulontatyökaluja on julkaistu (17), mutta paikalliset mallit ovat todennäköisesti toimivampia. Esimerkki seulonta-algoritmista on liitteessä (liitekuvio 1).
Lapsella sepsisepäily perustuu kliiniseen tutkimukseen, jossa infektioepäilyn yhteydessä todetaan tai epäillään elinhäiriöitä (taulukko 1). Lapsipotilailta tulisi etsiä sepsistä ja septistä sokkia päivystyskäyntien yhteydessä mahdollisimman systemaattisesti (2).
Jos tilanne on epäselvä, lasta seurataan kliinistä tutkimusta tiheästi toistaen päivystyksessä tai vuodeosastolla. Seurannan on oltava tavoitteellista ja painotuttava elinhäiriöiden systemaattiseen etsintään, ei pelkkään yleisvaikutelmaan tai laboratoriotutkimuksiin.
Elintoimintojen toistettuun arvioon sopivat erilaiset pisteytysjärjestelmät, kuten Pediatric Early Warning Signs (PEWS), joihin on liitetty selkeät iänmukaiset viitearvot (18). Vaikka lapsella ei olisi sepsistä, hänellä voi silti olla hoitoa vaativa infektio tai muu sairaus. Toistettu arvio ja systemaattinen lähestymistapa auttavat myös niiden havaitsemisessa.
Septisten elinhäiriöiden toteaminen
Sepsis ja septinen sokki ovat kliinisiä diagnooseja. Elinhäiriöitä etsitään systemaattisesti (taulukko 1) ja iänmukaisia viitearvoja hyödyntäen (18). Laboratoriokokeista tai kuvantamistutkimuksista voidaan saada lisäapua elinhäiriöiden toteamiseen sekä bakteeri- ja virustaudin erotteluun (taulukko 2). Nykyiset laboratoriotutkimukset eivät riitä sepsiksen diagnosointiin tai poissulkemiseen.
Hengitysvajauksen ja happeutumishäiriön toteaminen ei olennaisesti poikkea niiden toteamisesta aikuispotilailta lukuun ottamatta hengitystiheyden iänmukaisia viitearvoja (18). Hengitystyön lisäksi on aina arvioitava hengitystiheyttä ja kaasujenvaihtoa, vähintään saturaatiotasoa pulssioksimetrillä. Verenkiertovajauksen ja kudosverenkierron heikentymisen merkkeinä käytetään lapsilla pulssin ja verenpaineen tasoa, tajunnantasoa, virtsaneritystä ja kapillaaritäyttöaikaa (11). Matala verenpaine on lapsella pitkälle edenneen verenkiertovajauksen merkki.
Tajunnantasoa seurattaessa on opeteltava tunnistamaan pienen lapsen sekavuus, joka ilmenee usein poikkeavana itkuisuutena ja levottomuutena. On opittava erottamaan väsymys ja heikentynyt tajunnantaso toisistaan. Lapsen kuuluu reagoida herättelyyn avaamalla silmät, puhumalla tai noudattamalla kehotuksia ja havainnoida ympäristöään väsyneenäkin.
Poikkeavan hyytymisaktivaation (tukos- tai vuototaipumuksen) voi joskus todeta petekkioista ja mustelmista. Laboratoriokokeista (taulukko 2) on hyötyä sekä poikkeavan hyytymisaktivaation että maksan ja munuaisten toiminnan häiriön osoittamisessa. Kreatiniinitasolla on huono sensitiivisyys pienillä lapsilla, joilla on vähäinen lihasmassa. Diureesin seuraaminen ja happo-emästaseen arviointi antavat luotettavamman kuvan munuaistoiminnasta.
Kuume saattaa vaikeuttaa lapsen elinhäiriöiden arviointia, sillä kuumeinen lapsi on usein valitteleva, takykardinen ja väsynyt. Kehon lämpötilan nousu yhdellä asteella nostaa syketasoa noin 10 lyöntiä minuutissa (19). Siksi kaikille kuumeisille lapsille annetaan kuumetta alentava lääkitys päivystykseen tullessa, ja elinhäiriöiden arvio toistetaan kuumeen laskettua 30–60 min myöhemmin.
Aikuiset sepsispotilaat voidaan tunnistaa elinhäiriöiden qSOFA-pisteytyksellä. Siinä annetaan piste poikkeavasta tajunnantasosta, matalasta verenpaineesta ja kohonneesta hengitysfrekvenssistä (1). Samantyyppinen työkalu saattaa auttaa tunnistamaan septiset lapset päivystyksessä (20).
Nopea hoidon aloitus parantaa ennustetta
Sepsiksen viiveetön tunnistaminen ja nopeasti aloitettu, oikein kohdennettu mikrobilääke ja nestehoito parantavat ennustetta (21). Jokainen tunti ennen mikrobilääkkeen aloittamista lisää septisen lapsen kuolleisuutta (22,23). Septisessä sokissa mikrobilääkitys tulisi aloittaa viimeistään tunnin kuluessa ja sepsiksessä kolmen tunnin kuluessa päivystykseen saapumisesta. Tässä vaiheessa potilas on yleensä sairaalapäivystyksessä, mutta pitkien välimatkojen alueilla kaikissa päivystyspisteissä tulee olla valmius aloittaa lapsen septisen sokin hoito.
Sepsiksen hoito aloitetaan heti, kun sepsis todetaan (kuvio 1). Laboratoriokokeiden vastauksia ei ole syytä odotella. Lapselle asetetaan suonikanyyli, josta otetaan veriviljelynäyte (taulukko 2), ja mikrobilääke annostellaan heti sen jälkeen (taulukko 3).
Jos lapsella on verenkiertovajauksen merkkejä (taulukko 1), hän tarvitsee nestehoitoa ja mahdollisesti verenkierron tukilääkitystä. Näin turvataan riittävä kudosverenkierto ja siten hapentarjonta tärkeimpiin elimiin ja estetään lisävaurioiden syntyminen. Septisessä sokissa verenkiertovajaus aiheutuu muutoksista verisuonten endoteelin toiminnassa, sydämen pumppausfunktiossa ja mikroverenkierron muutoksista. Kudosverenkierto voi siten olla riittämätön, vaikka lapsen verenpaine olisikin normaali.
Verenkiertovajauksessa lapselle annostellaan boluksina kirkasta, isotonista tai lähes isotonista glukoositonta nestettä 10–20 ml/kg. Mieluimmin käytetään balansoitua nestettä (esimerkiksi Plasmalyte, Ringerin liuos). Jos infuusiopumppua ei ole saatavilla tai se ei ole tuttu, pienelle lapselle on yksinkertaisinta annostella nesteboluksia ruiskuista (kuva 1).
Nestehoidon vastetta seurataan arvioimalla toistetusti sykkeen, kapillaaritäytön, ääreisosien lämmön ja mahdollisuuksien mukaan laktaattitason muutosta. Lisäksi etsitään nestelastin kehittymisen merkkeinä hengityksen vaikeutumista, kuivaa yskää ja maksan suurenemista. Jokaisen nesteboluksen tarve arvioidaan kriittisesti, sillä liiallinen nestetäyttö saattaa lisätä kuolleisuutta myös lapsipotilailla (9).
Mikäli nestelastista ei ole viitteitä, ensimmäisen tunnin aikana voidaan toistaa nesteboluksia (10–20 ml/kg) noin 2–3 kertaa, yhteenlaskettuna 40–60 ml/kg määrään saakka. Jos tämä ei korjaa heikentyneen kudosverenkierron kliinisiä merkkejä (taulukko 1), lapsella on septinen sokki, ja hän tarvitsee verenkierron tukilääkitystä. Tukilääkitys aloitetaan aiemmin, jos kehittyy nestelastin merkkejä tai lapsen verenpaine on selvästi laskenut.
Päivystys- ja ensihoitotyössä tuttu verenkierron tukilääke on noradrenaliini, jota voidaan hyvin käyttää lapsille. Lapsilla vaihtoehtona on myös adrenaliini. Noradrenaliini ja adrenaliini voidaan antaa infuusiona perifeeriseen suoneen, kunnes keskuslaskimokatetrin asettaminen on mahdollista.
Verenkierron tukilääkkeet annostellaan infuusiopumpulla. Vakiolaimennoksia käytettäessä infuusionopeudet jäävät lapsilla pieniksi. Tasaisen infuusion varmistamiseksi samaan linjaan täytyy silloin infusoida jotakin perusnestettä lääkeinfuusion “viejänä" (noin 3 ml/kg/h). Perusneste on alle kouluikäisillä mieluiten 5 % glukoosia sisältävä, isotoninen kirkas neste, ja vanhemmilla lapsilla alkuvaiheessa glukoositon, ellei ole todettu hypoglykemiaa.
Myös hoitovastetta seurataan elinhäiriöistä
Sepsiksen hoidon tavoitteena on kudosverenkierron normaalistuminen siten, että elinhäiriöiden korjautuminen voi alkaa eikä uusia synny. Verenkiertovajauksen korjaantumisen merkkinä takykardinen syke hidastuu, kapillaaritäyttö nopeutuu, ja verenpainetaso nousee. Kohde-elinten verenkierron korjaantuessa myös diureesi ja tajunnantaso normaalistuvat. Näiden parametrien seuranta on avainasemassa sepsispotilaan koko hoidon ajan (24).
Kuten aikuisilla sepsispotilailla, myös lapsilla suurentunut laktaattipitoisuus liittyy huonompaan ennusteeseen (25). Yksittäinen laktaattiarvo ei ole lapsilla sepsiksen diagnostinen kriteeri, mutta laktaattipitoisuuden normaalistuminen alkuhoidossa vähentää elinhäiriöiden kestoa (26). Laktaatin määrittäminen ja kontrollointi on siten tarpeen lapsillakin. Laktaatti määritetään mieluiten valtimoverinäytteestä.
Mikrobilääkehoito sepsiksessä
Varhain aloitettu osuva mikrobilääkehoito on lapsen sepsiksen tärkeimpiä ennustetekijöitä (17,22). Ennen mikrobilääkityksen aloittamista otetaan veriviljely, ellei se merkittävästi hidasta hoidon aloittamista. Muita mikrobiologisia näytteitä, kuten virtsan, aivoselkäydinnesteen ja märkäpesäkkeiden bakteeriviljelyitä kerätään talteen mahdollisimman kattavasti, tarvittaessa vielä mikrobilääkehoidon aloittamisen jälkeenkin.
Infektiofokusta etsittäessä kliininen tutkimus ja esitiedot ovat tärkeimmät. Lapsi riisutaan riittävästi, iho tarkastetaan, kuunnellaan sydän ja keuhkot, tutkitaan niskajäykkyys sekä tarkistetaan nielu ja tärykalvot. Raajojen punoitus ja kipu selvitetään palpoiden, ja tutkitaan suuret nivelet. Lapsilla harvinaista nekrotisoivaa pehmytkudosinfektiota epäiltäessä kirurgia konsultoidaan heti.
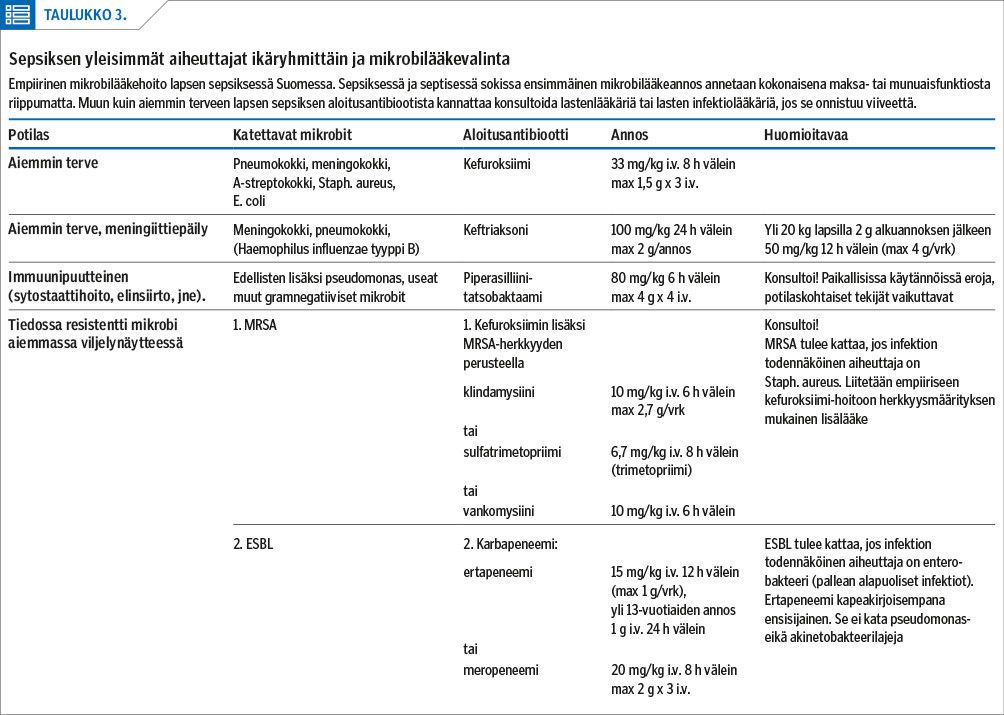
Lapsen aiempi terveydentila, matkustusanamneesi, perussairaudet, resistenttien mikrobien kantajuus sekä aikaisemmat viljelyvastaukset huomioidaan antimikrobin valinnassa (taulukko 3). Perusterveillä lapsilla riittää kotisyntyisessä infektiossa kapeampikirjoinen antibiootti kuin lapsilla, joiden immuunipuolustus on sairauden tai hoidon vuoksi heikentynyt, tai joilla on vastikään ollut sairaala- ja mikrobilääkehoitoja (taulukko 3). Heti viljelyvastausten valmistuttua kohdennetaan mikrobilääke infektion aiheuttajaan. Tämä on yleensä mahdollista viimeistään 36 tunnin kuluttua hoidon alkamisesta (27).
Sepsiksessä veriviljelyssä ei ole mikrobikasvua noin kolmasosassa tapauksista (2), eikä veriviljelypositiivinen infektio aina merkitse sepsistä. Silti THL:n veriviljelylöydöksistä saa käsitystä invasiivisten infektioiden bakteerietiologiasta Suomessa (28). Yli 1-vuotiaiden lasten yleisin veriviljelylöydös on Staphylococcus aureus. Muita tyypillisiä löydöksiä tässä ikäryhmässä ovat Escherichia coli, Streptococcus pyogenes sekä Streptococcus pneumoniae, joskin pneumokokkirokotusten takia viimeksi mainitun esiintyvyys on vähentynyt. Alle vuoden ikäisillä lapsilla veriviljelyissä tavataan lisäksi Streptococcus agalactiaeta, Escherichia colia sekä Enterococcus fecalista.
Mikrobilääke valitaan siten, että kaikki todennäköiset taudinaiheuttajat tulevat katetuksi riittävällä varmuudella (taulukko 3). Vaikka penisilliini kattaa tyypilliset perusterveen lapsen sepsiksen aiheuttajat (pneumokokin, A-streptokokin ja lisäksi meningokokin), ja vaikka se on monissa muissa vaikeissa infektioissa hyvä ensilinjan lääke, septisen lapsen empiiriseksi mikrobilääkkeeksi on syytä valita kefuroksiimi. Se kattaa myös E. colin ja Staphylococcus aureuksen (29,30,31).
Keftriaksoni penetroituu hyvin keskushermostoon ja kattaa myös Hemofilus influenzae tyyppi B:n ja muita gramnegatiivisia sauvoja, joten se on meningiitin empiirisenä hoitona ensisijainen. Toksisessa shokkioireyhtymässä klindamysiinin liittäminen hoitoon vähentää toksiinin muodostusta (32). Maha-suolikanavasta lähtöisin olevissa infektioissa hoitoon liitetään anaerobit kattava lääke, kuten metronidatsoli (2).
Paikallista resistenssitilannetta tulee seurata aktiivisesti. Gramnegatiivisten sauvojen ESBL-kantojen esiintyvyys on ollut Suomessakin hitaassa kasvussa 10 viime vuoden aikana. Alle 20-vuotiailla laajakirjoista beetalaktamaasia tuottavien E. coli -kantojen osuus oli kuitenkin vain 2,8 % vuonna 2019 (33).
Varmista mahdollisuus tehohoitoon
Perusterveydenhuollossa tulee osata epäillä lapsen sepsistä ja ohjata lapsi viivyttelemättä jatkohoitoon paikkaan, jossa on mahdollisuus tehohoitoon. Lapsen septinen sokki on tunnistettava kaikissa päivystyspisteissä. Jos jatkohoitoon pääsemiseen kuluu yli tunti, sokin neste- ja mikrobilääkehoito on yleensä aloitettava lähettävässä yksikössä tai siirtomatkalla.
Sairaalassa ja lastenpäivystyksessä sepsis tulisi tunnistaa ja aloittaa mikrobilääkehoito, nestehoito ja elinhäiriöiden tukihoidot viiveettä – sepsiksessä kolmen tunnin aikana ja septisessä sokissa tunnissa.
Septistä lasta tarjotaan hoitoon teho-osastolle. Lasten tehohoidon järjestelyt vaihtelevat yliopistosairaalapiireittäin. Kriittisesti sairaan lapsen siirrosta tulee konsultoida vastaanottavaa yksikköä jo siirtoon valmistauduttaessa, jotta optimoidaan lapsen hoito siirron ajaksi ja varmistutaan siitä, että lapsi siirretään suoraan tarkoituksenmukaisimpaan hoitopaikkaan.
Tehohoito sepsiksessä ja septisessä sokissa
Jos huono kudosperfuusio jatkuu nestetäytöstä ja vasopressorilääkityksestä huolimatta, teho-osastolla voidaan aloittaa inotrooppinen eli sydämen supistuvuutta lisäävä lääkitys (levosimendaani tai milrinoni, joskus adrenaliini). Hengitystä ja kaasujenvaihtoa tuetaan noninvasiivisesti, ellei tajunnantaso, hapenkulutus tai happeutumishäiriön aste edellytä invasiivista hengityskonehoitoa. Osalle potilaista kehittyy septinen munuaisvaurio (AKI, acute kidney injury), jonka hoidoksi aloitetaan tarvittaessa munuaiskorvaushoito.
Jos septinen sokki jatkuu, vaikka nestehoito ja verenkierron tukilääkitys on optimoitu, voidaan harkita kehonulkoista kaasujenvaihtoa eli ECMO-hoitoa. Sitä on pohdittava myös sepsikseen liittyvässä kriittisessä happeutumishäiriössä (PARDS, pediatric acute respiratory distress syndrome), jos muu hoito ei auta.
Hus Uudessa Lastensairaalassa annetaan ECMO-hoitoa, ja ECMO-ryhmä voi hakea lapsen hoitoon Etelä-Suomen alueelta. Hoito ei sovellu kaikille eikä auta enää myöhäisessä vaiheessa. Lisäksi se edellyttää paljon järjestelyjä. Siksi huonokuntoisen septisen lapsen hoitolinjoista kannattaa konsultoida Uuden Lastensairaalan teho-osastoa hyvissä ajoin.
Vaikka pysyviltä elinvaurioilta vältyttäisiin, tehohoitojakson jälkeen voi ilmetä pitkäkestoisia fyysisiä, psyykkisiä ja neurokognitiivisia jälkioireita. Pitkittyneen inflammaation, elinhäiriöiden sekä pitkän sairaala- ja tehohoitojakson laukaisemaa oirekokonaisuutta nimitetään lapsillakin tehohoidon jälkeiseksi oireyhtymäksi (PICS, post-intensive care syndrome) (34,35). Sepsiksestä toipuneilla lapsilla on haasteita erityisesti oppimisessa ja koulumenestyksessä (36). Jos tehohoidossa olleella lapsella ilmenee uusia hankalahoitoisia oireita, myös tehohoitoa antanutta yksikköä voi konsultoida ja miettiä yhdessä selvittelystrategiaa. Perhe saattaa tarvita tukea tehohoitovaiheen jälkeenkin (37).
Lasten sepsiksen ja sepsiskuolemien ehkäisy
Varhainen hoidon aloitus parantaa sepsiksen ennustetta, joten sepsiskuolemia voitaisiin mahdollisesti vähentää lisäämällä vanhempien, hälytyskeskusten ja neuvontapalveluiden tietoisuutta hälyttävistä oireista (taulukko 1) sekä panostamalla päivystyspoliklinikoilla sepsiksen varhaiseen tunnistamiseen (liitekuvio 1) (2). Maailmanlaajuisesti keskeisiä keinoja vähentää lasten sepsissairastavuutta ja -kuolleisuutta ovat hyvä rokotekattavuus, lasten aliravitsemuksen, ripulitautien, HIV:n ja malarian ehkäisy (38).
Lopuksi
Parhaillaan tutkitaan mahdollisuuksia seuloa sepsispotilaita äkillisesti sairastuneiden lasten joukosta hyödyntämällä biomarkkereita. Vastedes merkkiaineita ja algoritmeja hyödynnettäneen myös sepsiksen ilmiasujen ja erityisen suuren kuolemanriskin varhaisessa tunnistamisessa (39). Tämä mahdollistaisi hoidon oikean intensiteetin alusta asti (40). Kansainvälinen tehohoitoyhdistys pyrkii lisäksi määrittelemään lasten sepsiksen kriteerit tarkemmin ja antamaan ohjeita elinhäiriöiden luokittelusta ja ennusteesta (41).
Lasten infektiot ovat yleisiä, mutta on oleellista osata epäillä sepsistä. Toistaiseksi lapsen sepsiksen diagnostiikassa on turvauduttava esitietoihin, lapsen huolelliseen tutkimiseen ja vitaaliarvoihin. Alkuvaiheen hoito (mikrobilääke, nestehoito, verenkierron tuki) annetaan kaikille septisille lapsille samoja periaatteita noudattaen.
Kiitämme arvokkaista kommenteista osastonylilääkäri Paula Rautiaista, lasten infektiolääkäri Tea Niemistä ja lastentautien erikoislääkäri Anna Nikulaa.
Heli Salmi, Saija Näse-Ståhlhammar, Elina Wärnhjelm, Laura Puhakka: Ei sidonnaisuuksia.
- 1
- Singer M, Deutschman CS, Seymour CW ym. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016;315:801–10.
- 2
- Weiss SL, Peters MJ, Alhazzani W ym. Surviving Sepsis Campaign International Guidelines for the Management of Septic Shock and Sepsis-Associated Organ Dysfunction in Children. Pediatr Crit Care Med 2020;21:e52-e106.
- 3
- Cavaillon J, Singer M, Skirecki T. Sepsis therapies: learning from 30 years of failure of translational research to propose new leads. EMBO Mol Med 2020;12:e10128.
- 4
- Leligdowicz A, Matthay MA. Heterogeneity in sepsis: new biological evidence with clinical applications. Crit Care 2019;23:80.
- 5
- Shankar-Hari M, Phillips GS, Levy ML ym. Developing a new definition and assessing new clinical criteria for septic shock: For the Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016;315:775–87.
- 6
- Rudd KE, Johnson SC, Agesa KM ym. Global, regional, and national sepsis incidence and mortality, 1990–2017: analysis for the Global Burden of Disease Study. Lancet 2020;395:200–11.
- 7
- Schlapbach LJ, Straney L, Alexander J ym. Mortality related to invasive infections, sepsis, and septic shock in critically ill children in Australia and New Zealand, 2002-13: a multicentre retrospective cohort study. Lancet Infect Dis 2015;15:46–54.
- 8
- Boeddha NP, Schlapbach LJ, Driessen GJ ym. Mortality and morbidity in community-acquired sepsis in European pediatric intensive care units: a prospective cohort study from the European Childhood Life-threatening Infectious Disease Study (EUCLIDS). Crit Care 2018;22:143.
- 9
- Maitland K, Kiguli S, Opoka RO ym. Mortality after fluid bolus in African children with severe infection. N Engl J Med 2011;364:2483–95.
- 10
- Mathias B, Mira JC, Larson SD. Pediatric sepsis. Curr Opin Pediatr 2016;28:380–7.
- 11
- Cruz AT, Lane RD, Balamuth F ym. Updates on pediatric sepsis. Journal of the American College of Emergency Physicians Open 2020;1:981–93.
- 12
- Goldstein B, Giroir B, Randolph A. International pediatric sepsis consensus conference: definitions for sepsis and organ dysfunction in pediatrics. Pediatr Crit Care Med 2005;6:2–8.
- 13
- Leteurtre S, Duhamel A, Salleron J ym. PELOD-2: an update of the PEdiatric logistic organ dysfunction score. Crit Care Med 2013;41:1761–73.
- 14
- Leteurtre S, Martinot A, Duhamel A ym. Validation of the paediatric logistic organ dysfunction (PELOD) score: prospective, observational, multicentre study. Lancet 2003;362:192–7.
- 15
- Cioffredi L, Jhaveri R. Evaluation and management of febrile children: A review. JAMA Pediatr 2016;170:794–800.
- 16
- Baraff LJ. Management of fever without source in infants and children. Ann Emerg Med 2000;36:602–14.
- 17
- Lane RD, Funai T, Reeder R ym. High reliability pediatric septic shock quality improvement initiative and decreasing mortality. Pediatrics 2016;138.
- 18
- Parshuram CS, Hutchison J, Middaugh K. Development and initial validation of the Bedside Paediatric Early Warning System score. Crit Care 2009;13:R135.
- 19
- Davies P, Maconochie I. The relationship between body temperature, heart rate and respiratory rate in children. Emerg Med J 2009;26:641–3.
- 20
- van Nassau SC, van Beek RH, Driessen GJ ym. Translating Sepsis-3 criteria in children: prognostic accuracy of age-adjusted quick SOFA Score in children visiting the emergency department with suspected bacterial infection. Front Pediatr 2018;6.
- 21
- Evans IVR, Phillips GS, Alpern ER ym. Association between the New York Sepsis Care Mandate and in-hospital mortality for pediatric sepsis. JAMA 2018;320:358–67.
- 22
- Weiss SL, Fitzgerald JC, Balamuth F ym. Delayed antimicrobial therapy increases mortality and organ dysfunction duration in pediatric sepsis. Crit Care Med 2014;42:2409–17.
- 23
- Kumar A, Roberts D, Wood KE ym. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit Care Med 2006;34:1589–96.
- 24
- Korppi M, Kröger L, Rantala H ym. Lastentautien päivystyskirja. Kustannus Oy Duodecim 2016.
- 25
- Schlapbach LJ, MacLaren G, Festa M ym. Prediction of pediatric sepsis mortality within 1 h of intensive care admission. Intensive Care Med 2017;43:1085–96.
- 26
- Scott HF, Brou L, Deakyne SJ ym. Lactate clearance and normalization and prolonged organ dysfunction in pediatric sepsis. J Pediatr 2016;170:149–4.
- 27
- Dierig A, Berger C, Agyeman PKA ym. Time-to-positivity of blood cultures in children with sepsis. Front Pediatr 2018;6:222.
- 28
- THL. Veri- ja selkäydinnestelöydökset. https://thl.fi/fi/web/infektiotaudit-ja-rokotukset/seurantajarjestelmat-ja-rekisterit/tartuntatautirekisteri/tartuntatautien-esiintyvyystilastot/veri-ja-selkaydinnesteloydokset. Viitattu 9.8.2021.
- 29
- Jenu S, Simons L, Pätäri-Sampo A ym. Lasten kotisyntyiset invasiiviset infektiot. Lääketieteellinen aikakauskirja Duodecim 2014;130:1445–51.
- 30
- THL. Somaattinen erikoissairaanhoito 2018. THL tilastoraportti 51, 2019.
- 31
- Kaplan SL, Schutze GE, Leake JAD ym. Multicenter surveillance of invasive meningococcal infections in children. Pediatrics 2006;118:979.
- 32
- Carapetis JR, Jacoby P, Carville K ym. Effectiveness of clindamycin and intravenous immunoglobulin, and risk of disease in contacts, in invasive group a streptococcal infections. Clin Infect Dis 2014;59:358–65.
- 33
- Räisänen K, Ilmavirta H. Bakteerien mikrobilääkeresistenssi Suomessa. Finres 2019. THL 2019.
- 34
- Rodriguez-Rubio M, Pinto NP, Manning JC ym. Post-intensive care syndrome in paediatrics: setting our sights on survivorship. Lancet Child Adolesc Health 2020;4:486–8.
- 35
- Watson RS, Choong K, Colville G ym. Life after critical illness in children-toward an understanding of pediatric post-intensive care syndrome. J Pediatr 2018;198:16–24.
- 36
- Herrup EA, Wieczorek B, Kudchadkar SR. Characteristics of postintensive care syndrome in survivors of pediatric critical illness: A systematic review. World J Crit Care Med 2017;6:124–34.
- 37
- Abela KM, Wardell D, Rozmus C ym. Impact of pediatric critical illness and injury on families: an updated systematic review. J Pediatr Nurs 2020;51:21–31.
- 38
- Kissoon N, Uyeki TM. Sepsis and the global burden of disease in children. JAMA Pediatr 2016;170:107–8.
- 39
- Wong HR, Caldwell JT, Cvijanovich NZ ym. Prospective clinical testing and experimental validation of the Pediatric Sepsis Biomarker Risk Model. Sci Transl Med 2019;11.
- 40
- Atreya MR, Wong HR. Precision medicine in pediatric sepsis. Curr Opin Pediatr 2019;31:322–7.
- 41
- Menon K, Schlapbach LJ, Akech S ym. Pediatric sepsis definition – A systematic review protocol by the pediatric sepsis definition taskforce. Crit Care Explor 2020;2:e0123.
Sepsis in children – suspect, detect organ dysfunction and begin treatment
Sepsis is a distinct syndrome, in which infection triggers an inappropriate immune response in the host, leading to organ dysfunction. In septic shock, despite fluid resuscitation, circulatory failure and signs of hypoperfusion are present, necessitating treatment with vasoactive medication.
Worldwide, 25 million children are estimated to have sepsis annually. Half of them do not have predisposing factors. When intensive care is available, the case fatality of paediatric sepsis is 5–6%, but rises to 10–20% in septic shock. In low-resource settings, mortality may reach 50%. In survivors, impairment of either physical, psychological, cognitive or social functioning often occurs.
In paediatric emergency care, sepsis should be suspected in any child who has infectious symptoms or is unwell. It is crucial to look for signs of organ dysfunction and repeatedly evaluate the child for their presence, as their presence is suggestive of sepsis and increases mortality. In larger units offering emergency care for children, a systematic screening tool for sepsis is recommended, and a protocol for treatment of sepsis and septic shock should be established.
Prompt antimicrobial treatment and fluid resuscitation increase survival in septic children. Consequently, antimicrobial treatment and fluid resuscitation should be started within 3 hours in sepsis, and during the first hour in septic shock. If possible, antimicrobial therapy should be individually tailored to cover the most likely pathogen, considering the child’s medical history, previous microbiological results and the plausible focus of the infection. Signs of tissue hypoperfusion should be systematically monitored during treatment, as the goal of fluid and vasoactive therapy is to reverse tissue hypoperfusion and, thereby, reverse organ dysfunction. Consequently, children with sepsis should be referred to a centre where intensive care is available.