Keskushermostolymfoomat: ensimmäinen kansallinen hoitosuositus
• Keskushermostolymfooma on harvinainen imukudossyöpä. Lymfooma rajoittuu aivoihin, silmiin, aivo-selkäydinkalvoihin ja/tai selkäytimeen.
• Diagnostinen näyte on tärkeää saada välittömästi lymfoomaepäilyn herättyä, ennen kortisonihoidon aloittamista.
• Tehokas primaarihoito on potilaan ennusteen kannalta oleellinen, ja hoidoilla pyritään pitkäkestoiseen remissioon.
• Kirjallisuuskatsauksessa kuvataan ajantasainen tieto taudin biologiasta, diagnostiikasta, hoidosta ja seurannasta perustuen ensimmäiseen kansalliseen keskushermostolymfoomien hoitosuositukseen.

Primaarinen keskushermostolymfooma on harvinainen imukudossyöpä, joka rajoittuu aivoihin, silmiin, aivoselkäydinkalvoihin ja/tai selkäytimeen. Kasvutapa on invasiivinen, ja tautimuutokset sijaitsevat koko aivoston alueella pieniä ja keskisuuria verisuonia ympäröiden.
Keskushermostokasvaimista 2–4 % ja imusolmukealueiden ulkopuolisista lymfoomista 4–6 % on primaarisia keskushermostolymfoomia. Niiden ennuste on huonompi kuin muiden lymfoomien (1,2). Ilmaantuvuus on kasvussa erityisesti yli 75-vuotiaassa väestössä, ja teollistuneissa maissa se on noin 4,7/1 000 000 (3,4).
Keskushermostolymfooman riskitekijöitä ovat hankinnainen ja synnynnäinen immuunivaje, kuten HIV ja elinsiirto, sekä sen jälkeinen lymfoproliferaatio (5,6). Valtaosa tapauksista todetaan kuitenkin immuniteetiltaan normaaleilla potilailla.
Yli 95 % tapauksista on diffuusia suurisoluista B-solulymfoomaa, joka keskushermostossa esiintyessään on oma tautientiteettinsä ja eroaa systeemisestä lymfoomasta sekä kliinisesti että molekyyligeneettisiltä ominaisuuksiltaan (7,8,9,10). Se on lääke- ja sädehoitoherkkä tauti, ja hoidoilla voidaan päästä pitkäkestoiseen remissioon. Veri-aivoeste rajoittaa kuitenkin muutoin tehokkaiden lääkeaineiden pääsyä keskushermostoon (11,12).
Diagnostiikka ja ennustetekijät
Keskushermostolymfooman ensioireet voivat olla monimuotoisia affisioalueen mukaan. Tyypillisiä ovat äkilliset tai nopeasti etenevät oireet, kuten kouristukset, tajuttomuus ja voimakkaat päänsäryt, mutta myös muistivaikeudet, kognition heikkeneminen, toiminnanohjauksen häiriöt tai persoonallisuuden muutokset voivat olla ensioireita. Silmäaffisio voi oireilla toistuvina iriitteinä tai toispuolisina näköoireina ja herättää ensin epäilyn hyvänlaatuisesta prosessista. Selkäytimen taudin oireet ovat tasokohtaisia.
Keskushermostolymfooma ei erotu aina tietokonetomografiassa. Diagnostiikka edellyttää varjoainetehosteista pään (+ tarvittaessa selkäytimen) magneettikuvausta sekä diagnoosin kiireellistä varmentamista histologisesta tai aivo-selkäydinnesteen tai lasiaisen sytologisesta näytteestä. Hoidon aloittamisella ja näin ollen myös diagnostiikalla on kiire. Kortikosteroidihoidon aloittamista ennen näytteenottoa tulisi välttää, jotta histologista lymfoomalöydöstä ei menetetä. Mikäli aivo-selkäydinnesteen pintamerkkiainetutkimuksesta tai lasiaisnäytteistä saadaan yhdessä kuvantamislöydösten kanssa riittävä osoitus keskushermostolymfoomasta eikä kudosnäytteen ottaminen välittömästi onnistu, kudosnäytteestä voidaan luopua moniammatillisella päätöksellä.
Näytteet tulkitsee hematopatologi (13,14). Silmälääkärin kliinistä tutkimusta ja tarvittaessa lasiaisnäytteen ottamista suositellaan kaikille.
Lymfooman systeeminen levinneisyys suljetaan pois kuten muissakin aggressiivisissa B-solulymfoomissa varjoainetehosteisella TT-kuvauksella ja tarvittaessa fluorideoksiglukoosi-positroniemissiotietokonetomografialla (FDG-PET). Lisäksi miehille tehdään kivesten kaikututkimus. HIV sekä hepatiitit B ja C suljetaan pois. Luuydinnäytteet tutkitaan, mikäli tähdätään kantasolusiirtoon.
Koska hoidot vaativat runsasta nesteytystä ja altistavat infektioille, suositellaan potilaan kokonaistilanteen mukaan harkitsemaan sydämen kaikukuvausta ja/tai keuhkojen toimintakokeita. Ajokykyyn on otettava myös kantaa.
Keskushermostolymfoomapotilaan ennusteen määrittelyssä käytetään yleisimmin IELSG-riskipisteytystä (International Extranodal Lymphoma Study Group) (taulukko 1). Se ei kuitenkaan toistaiseksi vaikuta hoitopäätöksiin (15).
Hoidot
Keskushermostolymfoomien hoito koostuu pääasiassa lääkehoidosta, eikä kirurgialla ole hoidollista roolia. Hoidon tavoite on ensisijaisesti kuratiivinen. Hoito suunnitellaan yksilöllisesti huomioiden potilaan ikä, perussairaudet ja elintoiminnot. Mikäli mahdollista, potilaat suositellaan hoidettavaksi kliinisissä lääketutkimuksissa.
Infektioiden hallinta on tärkeä osa hoitoja, ja diagnostisten näytteiden ottamisen jälkeen usein aloitettava kortikosteroidihoito pyritään lopettamaan asteittain mahdollisimman nopealla aikataululla.
Primaarihoito
Potilaan ennusteen kannalta olennaista on keskushermostolymfooman tehokas primaarihoito. Mahdollisuuksien mukaan hoidon pohjana on suuriannoksinen metotreksaatti, johon liittyvä runsas nesteytys edellyttää hyvää sydämen ja munuaisten toimintaa. Induktiohoidolla pyritään mahdollisimman hyvään hoitovasteeseen, ja täydentävän vakautus- eli konsolidaatiohoidon tavoitteena on mahdollisimman pitkä remissio.
Nuorempien (alle 70–75 v), hyväkuntoisten potilaiden induktiohoito on suuriannoksisen metotreksaatin pohjalle t yhdistelmäimmunokemoterapia (16). Optimaalisesta vakautushoidosta ei ole yksiselitteistä tutkimusnäyttöä, mutta yleisimmin käytetään karmustiini-tiotepaesihoitoa ja autologista kantasolusiirtoa (17,18,19). Vaikka vakautushoidossa sädehoidolla on saavutettu yhtä hyviä hoitotuloksia taudin etenemättömyysajalla mitattuna, sitä ei useimmiten pidetä ensisijaisena siihen yleisesti liittyvien neurologisten myöhäishaittojen vuoksi (17,20,21).
Vertailevaan tutkimusnäyttöön perustuvaa hoitosuositusta ei voida antaa iäkkäämpien (yli 70–75 v) potilaiden hoidosta, jossa kantasolusiirtoa ei voida käyttää. Induktiohoitona suositellaan suuriannoksiseen metotreksaattihoitoon pohjautuvaa immunokemoterapiaa, tarvittaessa potilaskohtaisesti muunneltuna (22,23,24,25,26,27,28,29). Vakautushoitona voidaan käyttää suun kautta annettavia solunsalpaajia, kuten temotsolomidia ylläpitohoitona (23,24).
Jos potilas ei kuntonsa tai elintoimintojensa vuoksi siedä suuriannoksista metotreksaattihoitoa, tavoitteena on oireiden lievitys, taudin etenemisen hidastaminen sekä elämänlaadun kohentaminen ja ylläpito. Hoitona voidaan käyttää esimerkiksi deksametasonia ja kokoaivosädehoitoa (30).
Silmäaffision hoito
Silmänsisäinen lymfooma voi olla ensimmäinen ilmentymä keskushermostolymfoomasta, ja suurella osalla potilaista tauti etenee muualle keskushermostoon myöhemmin (31). Potilaista 20–30 %:lla tauti todetaan samanaikaisesti silmien ja muun keskushermoston alueella (32).
Koska silmänsisäinen lymfooma on harvinainen, selkeää kansainvälistä hoitosuositusta ei ole. Hoidon perustana pidetään kuitenkin lasiaiseen pistettävää metotreksaattia ja/tai rituksimabia (33,34). Rituksimabia käytettäessä voidaan metotreksaattipistoksia antaa harvemmin, ja rituksimabia voidaan käyttää myös yksittäisaineena, jos metotreksaattihoitoon ei saada vastetta. Sädehoidon käyttöä rajaavat lukuisat akuutit ja viivästyneet haittavaikutukset, kuten mahdollisesti myöhemmin annettavaan metotreksaattihoitoon liittyvä sädehoidon jälkeisen verkkokalvonekroosin riski.
Keskushermostolymfooman silmärelapsissa sekä tilanteissa, joissa tautia todetaan primaaristi silmien lisäksi muualla keskushermostossa, silmien paikallishoito yhdistetään systeemihoitoon.
Uusiutuneen taudin hoito
Primaarisen keskushermostolymfooman uusiutumisriski on suuri. Riippumatta valitusta ensilinjan hoidosta tauti uusiutuu noin puolella potilaista ja 10–15 % ei saa vastetta ensilinjan hoitoon. Keskimääräinen aika taudin uusiutumiseen on 10–18 kuukautta, mutta myös myöhäiset uusiutumat ovat mahdollisia (35,36).
Uusiutuneen ja hoitoon reagoimattoman keskushermostolymfooman ennuste on huono, erityisesti taudin uusiutuessa vuoden kuluessa ensilinjan hoidoista (12). Myös potilaan yleisen suorituskyvyn ja kognitiivisen selviytymisen palautuminen ovat uusiutuneen taudin hoidon jälkeen usein huonompia. Tutkimusnäyttö uusiutuneen taudin hoidosta on puutteellista, ja myös uusiutunutta tautia sairastavat potilaat suositellaan ensisijaisesti hoidettavaksi kliinisten lääketutkimusten puitteissa.
Uusiutuneen taudin hoidon valintaan vaikuttavat potilaan aiemmin saamat hoidot, ikä ja yleiskunto sekä taudin uusiutumisnopeus. Jos metotreksaattipohjaisesta ensilinjan hoidosta on kulunut yli 6 kuukautta, ensisijainen hoitovaihtoehto on metotreksaattipohjainen hoito (37,38). Muina solunsalpaajina on käytetty mm. suuriannoksista sytarabiinihoitoa, tiotepaa, etoposidia ja temotsolomidia yhdessä rituksimabin kanssa (39,40,41). Autologista kantasolusiirtoa suositellaan soveltuville potilaille, jotka eivät ole saaneet sitä ensilinjan hoitona.
Oireenmukaisena hoitona voidaan käyttää deksametasonia. Oleellista on hyvä palliatiivinen hoito, kuten pahoinvoinnin ja sekavuuden hoito sekä kouristuskohtausten ehkäisy ja hoito.
Sädehoito
Kokoaivosädehoitoa suositellaan harkittavaksi vain silloin, kun solunsalpaajahoito ei sovi potilaalle iän, peruskunnon tai perussairauksien vuoksi tai hän ei saa vastetta siihen. Suurimmalla osalla potilaista tauti reagoi sädehoitoon, mutta uusii nopeasti, usein vuoden kuluessa.
Sädehoitoon liittyy huomattava neurotoksisuuden riski, erityisesti jos potilas on yli 60-vuotias, hän on saanut metotreksaattihoitoa edeltäneiden kuuden kuukauden aikana, kokonaissädehoitoannos on yli 36 Gy tai kertasädehoitoannos yli 1,5 Gy (42,43). Yleisin kokoaivosädehoidon aiheuttama neurologinen haitta on väsymys, joka voi kestää kuukausia.
Hoitovasteen arviointi
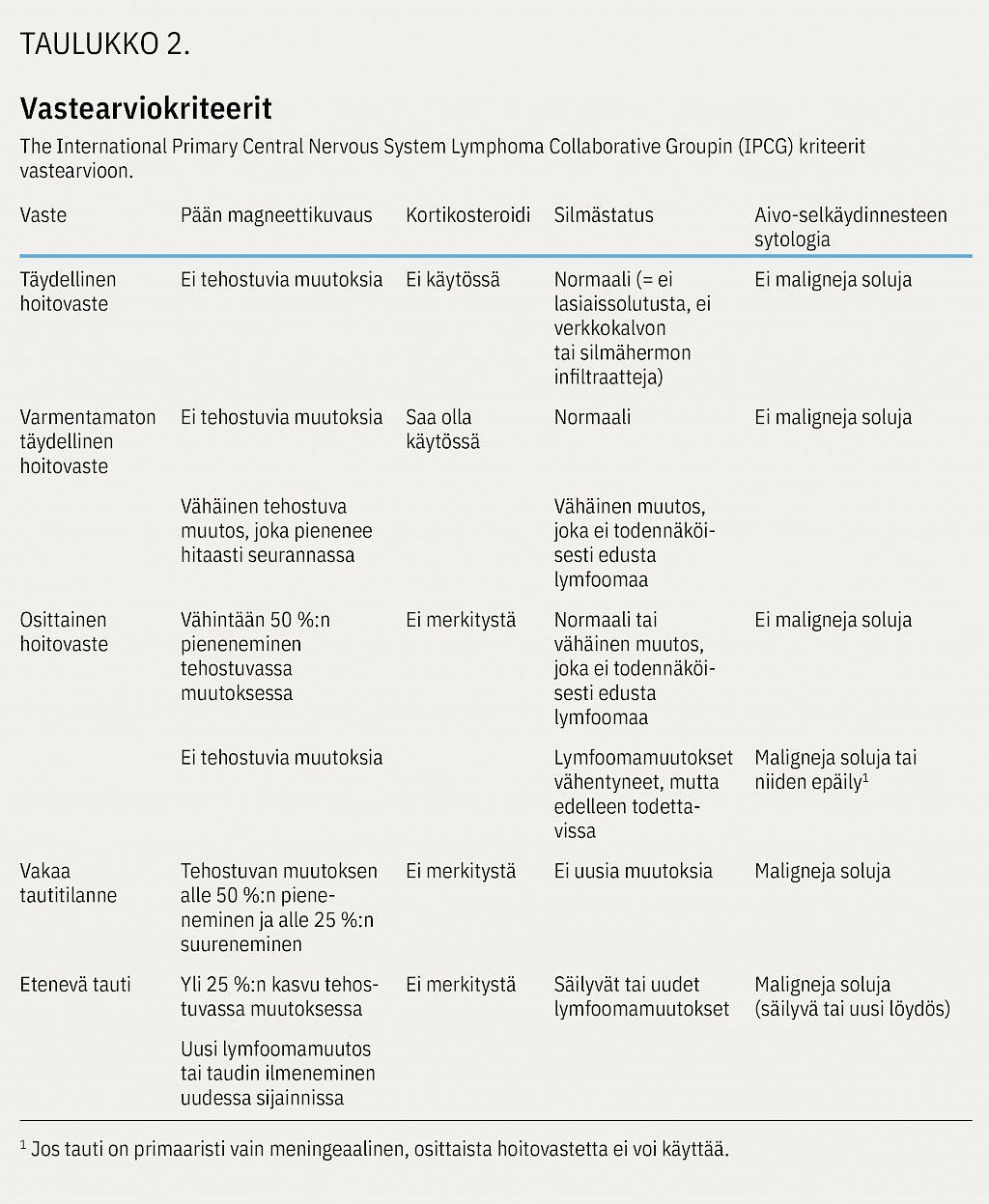
Täydellisen hoitovasteen saavuttaminen on potilaan ennusteen kannalta oleellinen. Hoitovaste arvioidaan magneettikuvauksella, yleisimmin joka toiselle kuurille tullessa. Primaaritilanteen poikkeavat silmä- ja aivo-selkäydinnestetutkimukset kontrolloidaan (44).
Täydellisessä hoitovasteessa ei todeta kuvantaen tehostuvia muutoksia eikä pahanlaatuisia löydöksiä aivo-selkäydinnesteessä tai silmän mikroskooppitutkimuksessa, eikä potilaalla ole ollut kahteen viikkoon käytössä kortikosteroideja. Vastearviokriteerit on esitetty taulukossa (taulukko 2) (13). Epäselvässä vasteessa voi FDG-PET-TT olla hyödyllinen (45,46,47,48).
Kuntoutus
Useimmilla keskushermostolymfoomapotilailla on merkittäviä neurologisia puutosoireita ja kuntoutus on oleellinen osa hoitoa. Potilaiden kuntoutumispotentiaali onnistuneen hoidon jälkeen on hyvä, mikä tulee ottaa huomioon hoitokuntoisuutta arvioidessa. Diagnoosihetken voinnin sijaan hoidon aloittamisen kriteerinä tulee olla se vointi, johon potilaan arvioidaan voivan onnistuneen hoidon jälkeen kuntoutua.
Kuntoutuminen alkaa usein jo ensimmäisen hoidon aikana tuumorin painevaikutuksen helpottaessa, hidastuu hoitojen edetessä, ja nopeutuu taas hoitojen loputtua. Nopea kuntoutuminen jatkuu noin vuoden ajan hoitojen jälkeen, mutta pientä paranemista voi tapahtua myöhemminkin, jopa vuosien ajan.
Fysioterapia, tarpeen mukaan toimintaterapia sekä puheterapia tulee aloittaa samanaikaisesti solunsalpaajahoitojen kanssa. Pitkään jatkuneeseen kortikosteroidihoitoon liittyvän lihaskadon ja osteoporoosin esto ja hoito ovat oleellisia.
Hoitojen jälkeen neurologisesti näennäisen hyvin toipuneille potilaille voi jäädä aivovamman jälkitilana voimakasta väsymystä, joka rajoittaa selviytymistä kokopäivätyössä. Neurologisen laitoskuntoutuksen ja työlääketieteen poliklinikan tutkimusjakson tarve arvioidaan potilaskohtaisesti, ja työikäisillä potilailla lopullinen arvio työkyvystä voidaan joskus tehdä vasta noin vuoden kuluttua hoitojen aloittamisesta. Kouristuslääkkeen jatkamisesta ja ajokyvyn arvioinnista konsultoidaan useimmiten neurologia.
Seuranta
Potilaat, joilla taudin uusiutuessa on mahdollisuus paranemiseen tähtäävään hoitoon, kuuluvat aktiiviseurannan piiriin. Oireiden seuranta ja kliininen tutkimus ovat seurannan kulmakiviä, eikä rutiinikuvantamisen hyödystä seurannassa ole näyttöä. Suositus kokonaisseuranta-ajaksi on viisi vuotta.
Outi Kuittinen: Apuraha laitokselle (Syöpäsäätiö). Tekijänpalkkiot (Kustannus Oy Duodecim).
Hanne Kuitunen: Luentopalkkiot (BMS, Roche).
Taina Reunamo: Virtuaalikongressien osallistumismaksut (BMS, Janssen Oncology, Takeda).
Susanna Mannisto: Matka-, majoitus- ja kongressikulut (Amgen, Gilead, Janssen, Roche).
Marjukka Pollari: Luentopalkkiot (Pfizer), matka-, majoitus- ja kongressikulut (Amgen, Gilead, Janssen, Roche).
- 1
- Villano JL, Koshy M, Shaikh H, Dolecek TA, McCarthy BJ. Age, gender, and racial differences in incidence and survival in primary CNS lymphoma. Br J Cancer 2011;105:1414–8.
- 2
- Dolecek TA, Propp JM, Stroup NE, Kruchko C. CBTRUS statistical report: primary brain and central nervous system tumors diagnosed in the United States in 2005-2009. Neuro Oncol 2012;14 suppl 5:v1–v49.
- 3
- Shiels MS, Pfeiffer RM, Besson C ym. Trends in primary central nervous system lymphoma incidence and survival in the U.S. Br J Haematol 2016;174:417–24.
- 4
- Puhakka I, Kuitunen H, Jäkälä P ym. Primary central nervous system lymphoma high incidence and poor survival in Finnish population-based analysis. BMC Cancer 2022;22:236. doi: 10.1186/s12885-022-09315-8
- 5
- Schabet M. Epidemiology of primary CNS lymphoma. J Neuro-oncol 1999;43:199–201.
- 6
- Mahale P, Shiels MS, Lynch CF, Engels EA. Incidence and outcomes of primary central nervous system lymphoma in solid organ transplant recipients. Am J Transplant 2018;18:453–61.
- 7
- Braggio E, Van Wier S, Ojha J ym. Genome-wide analysis uncovers novel recurrent alterations in primary central nervous system lymphomas. Clin Cancer Res 2015;21:3986–94.
- 8
- Giannini C, Dogan A, Salomão DR. CNS lymphoma: a practical diagnostic approach. J Neuropathol Exp Neurol 2014;73:478–94.
- 9
- Montesinos-Rongen M, Van Roost D, Schaller C, Wiestler OD, Deckert M. Primary diffuse large B-cell lymphomas of the central nervous system are targeted by aberrant somatic hypermutation. Blood 2004;103:1869–75.
- 10
- Swerdlow SH, Campo E, Pileri SA ym. The 2016 revision of the World Health Organization classification of lymphoid neoplasms. Blood 2016;127:2375–90.
- 11
- Ferreri AJM. Therapy of primary CNS lymphoma: role of intensity, radiation, and novel agents. Hematology 2017;2017(1):565–77.
- 12
- Langner-Lemercier S, Houillier C, Soussain C ym. Primary CNS lymphoma at first relapse/progression: characteristics, management, and outcome of 256 patients from the French LOC network. Neuro Oncol 2016;18:1297–303.
- 13
- Fox CP, Phillips EH. Guidelines for the diagnosis and management of primary central nervous system diffuse large B-cell lymphoma. Br J Haematol 2019;184:348–63.
- 14
- Hoang-Xuan K, Bessell E, Bromberg J ym. Diagnosis and treatment of primary CNS lymphoma in immunocompetent patients: guidelines from the European Association for Neuro-Oncology. Lancet Oncol 2015;16:e322–32.
- 15
- Ferreri AJ, Blay JY, Reni M ym Prognostic scoring system for primary CNS lymphomas: the International Extranodal Lymphoma Study Group experience. J Clin Oncol 2003;21:266–72.
- 16
- Ferreri AJ, Cwynarski K, Pulczynski E ym. Chemoimmunotherapy with methotrexate, cytarabine, thiotepa, and rituximab (MATRix regimen) in patients with primary CNS lymphoma: results of the first randomisation of the International Extranodal Lymphoma Study Group-32 (IELSG32) phase 2 trial. Lancet Haematol 2016;3:e217–27.
- 17
- Ferreri AJM, Cwynarski K, Pulczynski E ym. Whole-brain radiotherapy or autologous stem-cell transplantation as consolidation strategies after high-dose methotrexate-based chemoimmunotherapy in patients with primary CNS lymphoma: results of the second randomisation of the International Extranodal Lymphoma Study Group-32 phase 2 trial. Lancet Haematol 2017;4:e510–e23.
- 18
- Kasenda B, Schorb E, Fritsch K, Finke J, Illerhaus G. Prognosis after high-dose chemotherapy followed by autologous stem-cell transplantation as first-line treatment in primary CNS lymphoma--a long-term follow-up study. Ann Oncol 2012;23:2670–5.
- 19
- Illerhaus G, Kasenda B, Ihorst G ym. High-dose chemotherapy with autologous haemopoietic stem cell transplantation for newly diagnosed primary CNS lymphoma: a prospective, single-arm, phase 2 trial. Lancet Haematol 2016;3:e388–97.
- 20
- Korfel A, Thiel E, Martus P ym. Randomized phase III study of whole-brain radiotherapy for primary CNS lymphoma. Neurology 2015;84:1242–8.
- 21
- Herrlinger U, Schäfer N, Fimmers R ym. Early whole brain radiotherapy in primary CNS lymphoma: negative impact on quality of life in the randomized G-PCNSL-SG1 trial. J Cancer Res Clin Oncol 2017;143:1815–21.
- 22
- Rubenstein JL, Hsi ED, Johnson JL ym. Intensive chemotherapy and immunotherapy in patients with newly diagnosed primary CNS lymphoma: CALGB 50202 (Alliance 50202). J Clin Oncol 2013;31:3061–8.
- 23
- Glass J, Won M, Schultz CJ ym. Phase I and II study of induction chemotherapy with methotrexate, rituximab, and temozolomide, followed by whole-brain radiotherapy and postirradiation temozolomide for primary CNS lymphoma: NRG Oncology RTOG 0227. J Clin Oncol 2016;34:1620–5.
- 24
- Pulczynski EJ, Kuittinen O, Erlanson M ym. Successful change of treatment strategy in elderly patients with primary central nervous system lymphoma by de-escalating induction and introducing temozolomide maintenance: results from a phase II study by the Nordic Lymphoma Group. Haematologica 2015;100:534–40.
- 25
- Morris PG, Correa DD, Yahalom J ym. Rituximab, methotrexate, procarbazine, and vincristine followed by consolidation reduced-dose whole-brain radiotherapy and cytarabine in newly diagnosed primary CNS lymphoma: final results and long-term outcome. J Clin Oncol 2013;31:3971–9.
- 26
- Omuro A, Chinot O, Taillandier L ym. Methotrexate and temozolomide versus methotrexate, procarbazine, vincristine, and cytarabine for primary CNS lymphoma in an elderly population: an intergroup ANOCEF-GOELAMS randomised phase 2 trial. Lancet Haematol 2015;2:e251–9.
- 27
- Fritsch K, Kasenda B, Schorb E ym. High-dose methotrexate-based immuno-chemotherapy for elderly primary CNS lymphoma patients (PRIMAIN study). Leukemia 2017;31:846–52.
- 28
- Seidel S, Pels H, Schlomer S ym. Twenty years follow-up of a pilot/phase II-trial on the Bonn protocol for primary CNS lymphoma. Neurology 2020;95(23):e3138–44.
- 29
- Pels H, Schmidt-Wolf IG, Glasmacher A ym. Primary central nervous system lymphoma: results of a pilot and phase II study of systemic and intraventricular chemotherapy with deferred radiotherapy. J Clin Oncol 2003;21:4489–95.
- 30
- Kurzwelly D, Glas M, Roth P ym. Primary CNS lymphoma in the elderly: temozolomide therapy and MGMT status. J Neuro-oncol 2010;97:389–92.
- 31
- Chan C-C, Sen HN. Current concepts in diagnosing and managing primary vitreoretinal (intraocular) lymphoma. Discov Med 2013;15:93–100.
- 32
- Chan C-C, Rubenstein JL, Coupland SE ym. Primary vitreoretinal lymphoma: a report from an International Primary Central Nervous System Lymphoma Collaborative Group symposium. Oncologist 2011;16:1589–99.
- 33
- Huang YC, Jou JR. Intravitreal injections of methotrexate in treatment of primary central nervous system lymphoma with intraocular involvement. Kaohsiung J Med Sci 2016;32:638–9.
- 34
- Soussain C, Malaise D, Cassoux N. Primary vitreoretinal lymphoma: A diagnostic and management challenge. Blood 2021;138:1519–34.
- 35
- Jahnke K, Thiel E, Martus P ym. Relapse of primary central nervous system lymphoma: clinical features, outcome and prognostic factors. J Neuro-oncol 2006;80:159–65.
- 36
- Nayak L, Hedvat C, Rosenblum MK, Abrey LE, DeAngelis LM. Late relapse in primary central nervous system lymphoma: clonal persistence. Neuro Oncol 2011;13:525–9.
- 37
- Pentsova E, Deangelis LM, Omuro A. Methotrexate re-challenge for recurrent primary central nervous system lymphoma. J Neuro-oncol 2014;117:161–5.
- 38
- Plotkin SR, Betensky RA, Hochberg FH ym. Treatment of relapsed central nervous system lymphoma with high-dose methotrexate. Clin Cancer Res 2004;10:5643–6.
- 39
- Kasenda B, Ihorst G, Schroers R ym. High-dose chemotherapy with autologous haematopoietic stem cell support for relapsed or refractory primary CNS lymphoma: a prospective multicentre trial by the German Cooperative PCNSL study group. Leukemia 2017;31:2623–9.
- 40
- Soussain C, Hoang-Xuan K, Taillandier L ym. Intensive chemotherapy followed by hematopoietic stem-cell rescue for refractory and recurrent primary CNS and intraocular lymphoma: Société Française de Greffe de Moëlle Osseuse-Thérapie Cellulaire. J Clin Oncol 2008;26:2512–8.
- 41
- Wong ET, Tishler R, Barron L, Wu JK. Immunochemotherapy with rituximab and temozolomide for central nervous system lymphomas. Cancer 2004;101:139-45.
- 42
- Hottinger AF, DeAngelis LM, Yahalom J, Abrey LE. Salvage whole brain radiotherapy for recurrent or refractory primary CNS lymphoma. Neurology 2007;69:1178–82.
- 43
- Nguyen PL, Chakravarti A, Finkelstein DM, Hochberg FH, Batchelor TT, Loeffler JS. Results of whole-brain radiation as salvage of methotrexate failure for immunocompetent patients with primary CNS lymphoma. J Clin Oncol 2005;23:1507–13.
- 44
- Abrey LE, Batchelor TT, Ferreri AJ ym. Report of an international workshop to standardize baseline evaluation and response criteria for primary CNS lymphoma. J Clin Oncol 2005;23:5034–43.
- 45
- Ahn SY, Kwon SY, Jung SH ym. Prognostic significance of interim 11C-methionine PET/CT in primary central nervous system lymphoma. Clin Nucl Med 2018;43:e259–e64.
- 46
- Karantanis D, O'Eill BP, Subramaniam RM ym. 18F-FDG PET/CT in primary central nervous system lymphoma in HIV-negative patients. Nucl Med Commun 2007;28:834–41.
- 47
- Palmedo H, Urbach H, Bender H ym. FDG-PET in immunocompetent patients with primary central nervous system lymphoma: correlation with MRI and clinical follow-up. Eur J Nucl Med Mol Imaging 2006;33:164–8.
- 48
- Birsen R, Blanc E, Willems L ym. Prognostic value of early 18F-FDG PET scanning evaluation in immunocompetent primary CNS lymphoma patients. Oncotarget 2018;9:16822–31.
Primary central nervous system lymphoma: the first national guideline
Primary central nervous system lymphoma (PCNSL) is a rare and aggressive lymphoma entity that affects the brain, eyes, spinal cord, and/or the cerebrospinal fluid. It accounts for 2–4% of all central nervous system (CNS) tumours and 4–6% of all extranodal lymphomas. It is sensitive to both drug and radiation therapy, and the standard of care consists mainly of immunochemotherapy. However, the blood-brain-barrier restricts the penetration of otherwise efficient drugs into the CNS, and the prognosis of PCNSL is worse than that of other lymphoma entities. Effective first line treatment is essential and can result in long term remission. This literature review summarizes the current knowledge on the biology, diagnostics, and treatment of PCNSL based on the first national treatment recommendation for PCNSL patients in Finland.
Outi Kuittinen, Hanne Kuitunen, Taina Reunamo, Susanna Mannisto, Marjukka Pollari
Marjukka Pollari
M.D., Ph.D., Specialist in Oncology
Oncology Department, Tampere University Hospital