Ihokasvainten diagnostiikka paranee kajoamattominkin keinoin
Ihosyövät ovat maailman yleisimpiä syöpiä. Niiden ilmaantuvuus on kasvanut jatkuvasti vuosikymmenten ajan – myös Suomessa.
Ihokasvainten diagnostiikkaa voidaan parantaa ja nopeuttaa oleellisilla esitiedoilla, kliinisellä tutkimuksella, dermatoskopialla ja muilla ihokasvainten kajoamattomilla kuvantamisilla.
Ihomuutoksesta otetun koepalan histopatologinen tutkimus on tärkeä diagnoosin varmentamiseksi, mikäli esitiedot ja edellä mainitut tutkimukset eivät riitä.

Silmämääräistä arviota ja koepalan ottoa käytetään yleisesti ihokasvainten tutkimiseen. Kajoamattomista menetelmistä Suomessa ihotautilääkäreillä on käytössä dermatoskopia ja yhdessä keskussairaalassa konfokaalimikroskopia. Maailmalla ja tutkimuskäytössä on myös muita ei-kajoavia kuvantamismenetelmiä.
Esitiedot
Potilaan esitiedot ovat tärkeitä arvioitaessa ihomuutoksen laatua. Oleellisia ovat muutoksen ilmaantumisen ajankohta, koon, muodon tai värin muutokset, kipu, haavautuminen, muutoksen aiemmat koepalat, toimenpiteet tai paikallishoidot (esim. jäädytys).
Aiemmat ihosyövät tai niiden esiasteet, pigmenttiluomien määrä, dysplastiset luomet, muut poikkeavat ihomuutokset, aurinkoaltistuksen määrä ja lähisuvun ihosyövät vaikuttavat arvioon.
Jos potilaalla on ollut melanooma, uuden melanooman suhteellinen riski on 9–10-kertainen. Jos potilaalla on dysplastisten luomien oireyhtymä ja yhdellä ensimmäisen asteen sukulaisella melanooma, on suhteellinen riski jo 8–127-kertainen.
Yksi dysplastinen luomi ei kuitenkaan lisää suhteellista melanoomariskiä. Oleellisia tietoja ovat lisäksi aiemmat säde- ja valohoidot sekä geneettinen ihosyöville altistava oireyhtymä.
Myös immunosupressio lisää ihosyöpäriskiä. Elinsiirtopotilailla useiden immunosupressiivisten lääkkeiden yhdistelmä on merkittävä riski, joka lisääntyy lääkityksen keston pidentyessä. Heillä suurin on okasolusyövän riski, joka on 65–250-kertainen (1,2,3,4,5).
Silmin tehty arvio
Ihomuutokset tutkitaan pääsääntöisesti silmin arvioiden koko iholta. Tällöin huomioidaan muutoksen sijainti, koko, muoto, symmetrisyys, väri, kasvaimen reuna ja sen tarkkuus.
Pigmenttimuutoksissa huomioidaan pigmentin tummuus, kirjavuus ja vaaleat alueet, jotka voivat viitata regressioon tai arpeen.
Myös muutoksen palpaatiolöydökset, kuten karheus tai kiinnikkeisyys voivat antaa viitteitä muutoksen syvyydestä. Verisuonitus, haavautuminen, verenpurkaumat, vallimaisuus tai arpimaisuus voivat viitata pahanlaatuiseen muutokseen. (3,4)
Dermatoskopia
Silmin tehtyä arviota voi tarkentaa dermatoskopialla (mm. Heine, Dermlite). Kyseessä on ihotautilääkärien yleisesti käyttämä tutkimusmenetelmä, jonka perustaidot ovat koulutuksella myös muun erikoisalan, mm. yleislääkärin, omaksuttavissa. Menetelmästä käytetään myös termejä dermoskopia ja epiluminesenssimikroskopia.
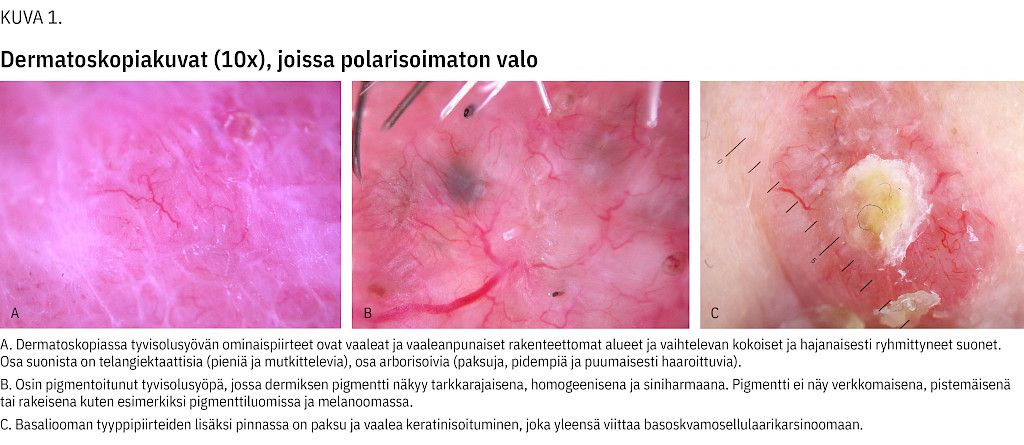
Dermatoskopiaa on käytetty eniten pigmenttimuutosten arviointiin, mutta myös pigmentittömät muutokset soveltuvat siihen (6–8, kuvat 1A-C). Perinteinen dermoskooppi on edullinen, optinen apuväline, joka koostuu suurentavasta ja tarkentavasta linssistä sekä led-lampusta. Suurennos on keskimäärin kymmenkertainen (9).
Dermoskooppi parantaa näkyvyyttä keratiinikerroksen läpi, jolloin epidermistä ja papillaarista dermistä voidaan tutkia silmin tehtyä arviota paremmin. Valona voi olla polarisoimaton tai polarisoitu valo.
Valon polarisaatio ohittaa marraskeden heijastukset, jolloin morfologiaa päästään tarkastelemaan syvemmällä ihossa. Polarisoimattoman valon kanssa väliaineella saavutetaan sama, mutta tällöin ei nähdä pinnan keratinisaatioon liittyviä löydöksiä. Useissa laitteissa voi vaihtaa polarisoimattomanta ja polarisoitua valoa. On myös digitaalisia dermoskooppeja, jotka välittävät kuvan tietokoneen näytölle arvioitavaksi, ja näiden suurennos vaihtelee (10–1000x) (10).
Osassa ihomuutoksia päästään tarkkaan diagnoosin dermatoskopian avulla, jolloin koepalaa ei tarvita (8). Dermatoskopian sensitiivisyys (90 % vs 71 %, (8)) ja spesifisyys (90 % vs 81 %) ovat paremmat kuin silmämääräisen arvioinnin. Tutkimus mahdollistaa morfologisten muutosten havainnoinnin aikaisemmassa vaiheessa (6,9,11). Strukturoitu koulutus on kuitenkin tarpeen, jolloin herkkyys ja tarkkuus paranevat (12).
Muut kajoamattomat kuvausmenetelmät
Digitaalinen luomikuvaus
Runsasluomisten potilaiden seurannassa käytetään apuna digitaalista luomikuvausta tai tekoälyyn perustuvia kuvauslaitteita. Automatisoitu kamera kuvaa ihon edestä, takaa ja molemmilta sivuilta ja tallentaa tiedot muistilevylle.
Seurantakäynnillä kuvaus toistetaan ja ohjelma vertaa uusia kuvia aiempiin. Poikkeavia luomia tarkastellaan näytön kuvaa suurentamalla ja/tai laitteeseen liitetyllä dermoskoopilla. Menetelmä on nopea ja pystyy havaitsemaan epäilyttävät muutokset silmää varhaisemmin. Vaikka laite on itseohjautuva, kliinikko päättää luomen poiston tarpeen (13).
Konfokaalimikroskopia
Reflektanssikonfokaalimikroskopia (RCM, mm. VivaScope) on laajalti kliinisessä käytössä maailmalla (14,15) ja tietojemme mukaan Suomessa yhdessä keskussairaalassa (Vaasa).
RCM-laitteita on kaupallisesti saatavilla, mutta käyttöä rajoittaa kallis hinta sekä kuvien tulkintaan vaadittava koulutus ja erityisosaaminen.
Konfokaalimikroskopiassa saadaan tavallista valomikroskooppia vastaava resoluutio. RCM:ssa tarkastellaan horisontaalisia leikkeitä, kun perinteisessä valomikroskopiassa leikkeet ovat vertikaalisia. RCM:ssa valonlähteenä on noin 830 nm:n laservalo, joka ohjautuu detektorille, missä tuotetaan mustavalkoinen kuva näytölle. Kuvaussyvyys on 200–300 µm, jolloin voidaan tutkia epidermistä ja papillaarista dermistä.
Tekniikkaa voidaan hyödyntää myös hoidon seurannassa tai leikkausalueen koon määrittämisessä. RCM vähensi pigmenttimuutosten koepalojen tarvetta alle puoleen verrattuna dermatoskopiaan.
RCM ei sovellu kasvainmuutoksien tutkimiseen, jos ne sijaitsevat syvemmällä ihossa. Reflektanssimikroskooppeja voidaan käyttää in vivo -diagnostiikkaan, jolloin kuvantamisella tarkennetaan diagnoosia tai paikannetaan edustava biopsian ottokohta. Ex vivo -diagnostiikassa muutoksen diagnoosin voi saada nopeasti esim. ihokasvaimen leikkauksen aikana ja se mahdollistaa digitaalisten leikkeiden lähettämisen konsultaatioon (14,16,17,18).
Optinen koherenssitomografia
Optisessa koherenssitomografiassa (OCT) tekniikka on analogista ultraäänelle (mm. VivoSight, SkinTell), mutta siinä käytetään infrapunavaloa. Tekniikalla syntyy vertikaalinen kuva, jossa kasvainalueet jättävät niukkakaikuisia alueita.
OCT:n dynaamisella versiolla voidaan kuvantaa kasvaimen pinnallisia verisuonia ja tunnistaa esim. basalioomien alatyyppejä. Pigmenttimuutosten diagnostiikassa OCT:n suorituskyky riippuu kasvaimen paksuudesta.
Menetelmän haasteita ovat kuvanlaadun huononeminen haavautuneissa ja hyperkeratoottisissa muutoksissa sekä vaikeasti saavutettavissa kuvauskohteissa, kuten esim. kasvojen uurteissa. OCT:n käyttöä rajoittaa kuvien tulkintaan vaadittava koulutus ja erityisosaaminen. Tekniikan etuna on mahdollisuus arvioida ihomuutoksen paksuutta esimerkiksi hoidettaessa ei-invasiivisia ihokasvaimia (16,19,20).
Spektrikuvantaminen
Spektrikuvantaminen on optisen kuvantamisen alalaji, joka perustuu valon taittumiseen, siroamiseen ja fluoresenssiin kuvattavassa kohteessa. Kasvainkudoksen optiset ominaisuudet vaihtelevat ja spektrissä havaitaan erot hyvän- ja pahanlaatuisen kudoksen välillä.
Multispektrilaitteissa käytetään alle kymmentä aallonpituutta ja hyperspektrilaitteissa kymmeniä eri aallonpituuksia, jolloin tarkkuus voi olla parempi. Spektrikuvantamisen voi helposti yhdistää tietokone- ja tekoälyavusteiseen tulkintaan, jolloin tulos on käyttäjän tiedoista riippumaton (21).
Multispektrilaitteita (mm. Melafind, SiaScopy) on tutkittu melanooman erottamisessa muista pigmenttimuutoksista. Näillä herkkyys on hyvä, mutta tarkkuus jää matalaksi (20,22). Keratinosyyttisyöpien osalta multispektrilaitteista ei ole riittävästi tutkimusta, jotta menetelmän herkkyydestä ja tarkkuudesta voitaisiin tehdä johtopäätöksiä (23).
Hyperspektrikuvantamista on tutkittu eri ihomuutoksissa (19,20) ja aktiivisesti myös Suomessa mm. aurinkokeratoosin, lentigo maligna –melanooman ja basalioomien rajojen määrittelyssä sekä ihokasvainten diagnostiikassa (24,25,26,27). Kaupallisesti on saatavilla multispektrilaitteita, joiden hinta on noin 1/10 RCM:n ja OCT:n hinnasta. Vastaavasti dermoskoopin hinta on noin 1/10 multispektrilaitteiden hinnasta.
Aktiivinen dermatoskopian käyttö on keino parantaa ihokasvainten diagnostiikkaa myös perusterveydenhuollossa, sillä muiden kajoamattomien kuvantamismenetelmien käyttö nykyisin rajoittuu erikoissairaanhoitoon tai tutkimuskäyttöön. Eri tekniikoita yhdistämällä voidaan kattaa eri menetelmien hyviä ominaisuuksia kliinisessä tutkimisessa (22). Optisten, ei-kajoavien kuvausmetetelmien edut ja haitat ovat taulukossa 1.
Histopatologinen tutkimus
Jos edellä mainittujen tutkimusten avulla ihokasvaimen tarkka diagnoosi ei ole mahdollinen, otetaan koepala histopatologiseen tutkimukseen. Ihomuutosten näytteenottoon on saatavana tarkkoja ohjeita (mm. 3,4,28), joihin koepaloja ottavien lääkäreiden kannattaa perehtyä.
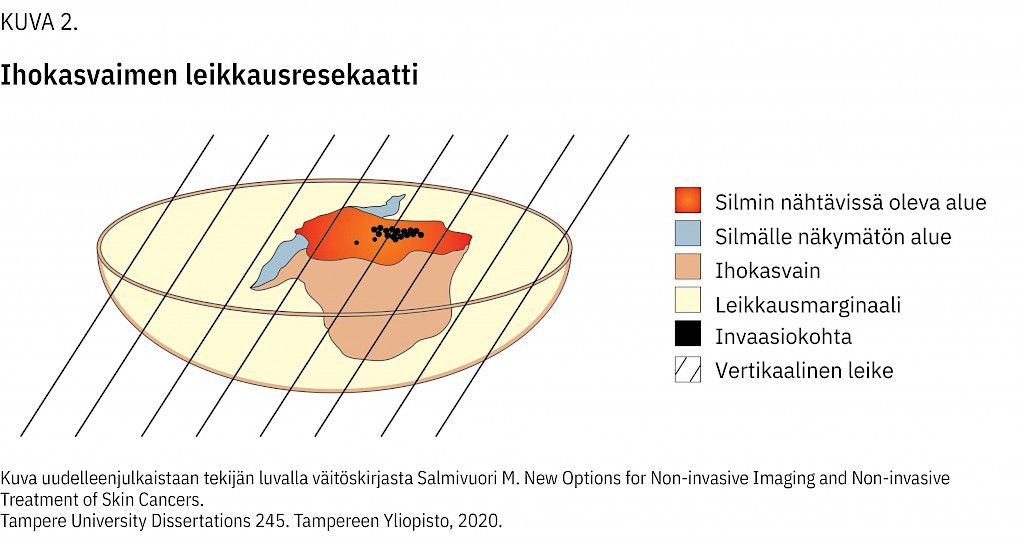
Edustavan koepalakohdan valinnassa dermatoskopiasta ja muista ei-kajoavista menetelmistä on apua (11). Tällöin leikkeisiin saadaan enemmän ihokasvainta (kuva 2).
Epäilyttävät pigmenttimuutokset suositellaan poistettavaksi kokonaan vähintään 1–2 mm marginaalilla. Kookkaista pigmenttimuutoksista on parempi ottaa kapea ja mahdollisimman pitkä veneviiltopalan muotoinen koepala kuin stanssibiopsia. Tällöin leikkeissä on enemmän kasvainta arvioitavaksi. Poikkeuksena on esimerkiksi kasvojen alue, josta voidaan ottaa stanssibiopsia.
Histopatologisen tutkimuksen avulla selvitetään kasvaimen morfologia, mahdollinen invaasio tyvikalvon läpi ja invaasiosyvyys. Patologin diagnoosi tarkentuu, kun lähetteessä on tarkat esitiedot ja kliininen kuvaus. Jos lähetettä täydennetään valokuvilla ja dermatoskopialöydöksillä, ne parantavat diagnostiikkaa. Näyte ihokasvaimesta, kuten poikkeava pigmenttimuutos, voidaan lähettää tutkittavaksi ihomuutosten diagnostiikkaan perehtyneelle dermatopatologille, joka on sekä ihotautien että patologian erikoislääkäri.
Lisäksi Suomessa on yksi (kirjoittajien tiedon mukaan) ihomuutoksien diagnostiikkaan perehtynyt patologi, joka on suorittanut dermatopatologian erilliskoulutuksen. Ongelma on, että patologilla ei usein ole valokuvia käytettävissä, johtuen muun muassa huonosti yhteensopivista potilastietojärjestelmistä.
Patologi voi hyödyntää immunohistokemiallisia värjäyksiä kasvaimen alkuperän tai muiden ominaisuuksien selvittämiseen. Huonosti erilaistuneissa kasvaimissa voidaan värjäyksillä selventää, kuinka syvälle kasvainkudos yltää ja onko perineuraalista invaasiota, joilla on oleellinen merkitys tarvittaviin marginaaleihin ja kliiniseen hoitotulokseen.
Ihokasvaimissa on usein ruskeaa melaniinipigmenttiä. Tämän vuoksi ihonäytteiden vasta-aineiden värjäykset kannattaa tehdä punaiseksi tai siniseksi, jolloin niiden tulkinta on helpompi.
Transkriptiotekijä SOX10:n vasta-aine ei värjää dendriittisiä soluja eikä histiosyyttejä, ja on yleensä positiivinen desmoplastisessa melanoomassa. SOX10 värjää mm. rauhasrakenteiden epiteeliä, mikä ei yleensä ole ongelma melanooman erotusdiagnostiikassa. SOX10-värjäyksen positiivisuus on solun tumassa, jolloin löydös on helpompi arvioida, kuin sytoplasmassa positiivisten vasta-aineiden.
Toinen lupaava vasta-aine melanoomien diagnostiikassa on PRAME (prefentially expressed antigen in melanoma), joka yleensä on positiivinen melanoomassa ja negatiivinen hyvänlaatuisissa luomissa. Jotta tällaisen värjäyksen tulos tulkitaan positiiviseksi, on positiivisten nevoidien solujen määrän oltava yli 75 % (29,30). Positiivista tulosta pidetään kohtuullisen spesifinä (yli 90 %). Väärien negatiivisten osuus melanoomanäytteissä on ollut vähintään 10 %, jopa 17 %. Tutkimuksissa näytemäärä on ollut yleensä vain kymmeniä (29,30), joissain 100–200 (31,32). Siksi kyseinen värjäystulos tulee suhteuttaa muihin löydöksiin, erityisesti histologiaan, ja värjäyksen käyttö tulee vielä tarkentumaan tulevaisuudessa.
Lopuksi
Esitiedot, kliininen tutkimus, dermatoskopia ja muut ei-kajoavat kuvantamismenetelmät riittävät osaan ihokasvainten diagnostiikasta tulevaisuudessakin. Ihokasvainten diagnostiikka kehittyy, jolloin myös koepalojen tarve vähenee. Tulevaisuudessa uusilla menetelmillä saatavaa tietoa tulkitaan tekoälyn ja neuraalisten verkkojen avulla (6,33,34). Tällöin potilastietojärjestelmiin tarvitaan sanallisen kuvauksen lisäksi digitaaliset kuvat ja tiedostot ihomuutoksista. Koepalan mikroskopia säilyy tulevaisuudessakin ihokasvainten tarkimpana diagnostiikan menetelmänä, jolloin myös harvinaisten ja diagnostisesti ongelmallisten ihokasvainten diagnostiikka tarkentuu.
Hanna Siiskonen: ammatinharjoittaja (Terveystalo)
Mari Salmivuori: apuraha (Ida Montinen säätiö), osakkeet (Revenion), matka-apuraha (Suomen ihotautilääkäriyhdistys ry)
Sari Koskenmies: korvaus käsikirjoituksesta (Finska Läkeresällskapet)
Leila Jeskanen: ammatinharjoittaja (Mehiläinen, SynLab Oy)
Katriina Lappalainen: ammatinharjoittaja (Mehiläinen, Vita Laboratoriot Oy)
- 1
- Lucas RM, McMichael AJ, Armstrong BK, Smith WT. Estimating the global disease burden due to ultraviolet radiation exposure. Int J Epidemiol 2008;37(3):654–67.
- 2
- Pitkäniemi J, Malila N, Tanskanen T ym. Syöpä 2019. Tilastoraportti Suomen syöpätilanteesta. Suomen Syöpäyhdistyksen julkaisuja nro 96. Helsinki: Suomen Syöpäyhdistys; 2021.
- 3
- Övermark M, Isoherranen K ym. Vaaraton luomi vai sittenkin ihomelanooma? Duodecim 2017;133(12):1212–9.
- 4
- Pitkänen S, Ylitalo L. Ihosyöpien diagnostiikka ja hoito 1. ed. Helsinki: Kustannus Oy Duodecim; 2020.
- 5
- Cameron M, Lee E ym. Basal cell carcinoma: Epidemiology; pathophysiology; clinical and histological subtypes; and disease associations. JAAD 2019;80(2):303–17.
- 6
- Weber P, Tschandl P, Sinz C, Kittler H. Dermatoscopy of Neoplastic Skin Lesions: Recent Advances, Updates, and Revisions. Curr Treat Opt in Oncol 2018;19(11):56.
- 7
- Yélamos O, Braun R, Liopyris K. Dermoscopy and dermatopathology correlates of cutaneous neoplasms. JAAD 2019;80(2):341–63.
- 8
- Yélamos O, Braun R ym. Usefulness of dermoscopy to improve the clinical and histopathologic diagnosis of skin cancers. JAAD 2019;80(2):365 –77.
- 9
- Saarinen K. Dermatoskopia primaarimelanooman diagnostiikassa. Duodecim. 2017;133(12):1225–9.
- 10
- Chen X, Lu Q, Chen C, Jiang G. Recent developments in dermoscopy for dermatology. J cosm dermatol 2021;20(6):1611–7.
- 11
- Mataca E, Migaldi M, Cesinaro A. Impact of Dermoscopy and Reflectance Confocal Microscopy on the Histopathologic Diagnosis of Lentigo Maligna/Lentigo Maligna Melanoma. Am J Dermatopathol 2018;40(12).
- 12
- De Bedout V, Williams N ym. Skin Cancer and Dermoscopy Training for Primary Care Physicians: A Pilot Study. Dermatol Pract & Cons 2021;11(1):e2021145.
- 13
- Fried L, Tan A, Bajaj S, Liebman T ym. Technological advances for the detection of melanoma: Advances in diagnostic techniques. JAAD 2020;83(4):983–92.
- 14
- Shahriari N, Grant-Kels J, Rabinovitz H ym. Reflectance confocal microscopy: Principles, basic terminology, clinical indications, limitations, and practical considerations. JAAD 2021;84(1):1–14.
- 15
- Shahriari N, Grant-Kels J, Rabinovitz H ym. Reflectance confocal microscopy: Diagnostic criteria of common benign and malignant neoplasms, dermoscopic and histopathologic correlates of key confocal criteria, and diagnostic algorithms, JAAD 2021;84(1):17–31.
- 16
- Giuffrida R, Conforti C, Di Meo N ym. Use of noninvasive imaging in the management of skin cancer. Curr opinion in oncol. 2020; 32:98-105.
- 17
- Farnetani F, Manfredini M, Chester J ym. Reflectance confocal microscopy in the diagnosis of pigmented macules of the face: differential diagnosis and margin definition. Photochem photobiol sci 2019;18(5):963–9.
- 18
- Malvehy J, Pérez-Anker J, Toll A ym. Ex vivo confocal microscopy: revolution in fast pathology in dermatology. Br J Dermatol. 2020;183(6):1011–1025.
- 19
- Dorrell D, Strowd L. Skin Cancer Detection Technology. Derm clinics 2019;37(4):527–36.
- 20
- Heibel H, Hooey L, Cockerell C. A Review of Noninvasive Techniques for Skin Cancer Detection in Dermatology. American J Clin Derm 2020;21(4):513–24.
- 21
- Goyal M, Knackstedt T, Yan S, Hassanpour S. Artificial intelligence-based image classification methods for diagnosis of skin cancer: Challenges and opportunities. Comput Biol Med. 2020;127:104065. doi:10.1016/j.compbiomed.2020.104065
- 22
- Blundo A, Cignoni A, Banfi T, Ciuti G. Comparative Analysis of Diagnostic Techniques for Melanoma Detection: A Systematic Review of Diagnostic Test Accuracy Studies and Meta-Analysis. Front Med 2021;8(637069).
- 23
- Ferrante di Ruffano L, Takwoingi Y ym. Computer-assisted diagnosis techniques (dermoscopy and spectroscopy-based) for diagnosing skin cancer in adults. Cochrane Database Syst Rev. 2018;12:CD013186. doi:10.1002/14651858.CD013186
- 24
- Neittaanmäki-Perttu N, Grönroos M ym. Detecting field cancerization using a hyperspectral imaging system. Lasers surg med 2013;45(7):410–7.
- 25
- Neittaanmäki N, Salmivuori M ym. Hyperspectral imaging in detecting dermal invasion in lentigo maligna melanoma. Br J Dermatol 2017;177(6):1742–4.
- 26
- Salmivuori M, Neittaanmäki N, Pölönen I ym. Hyperspectral imaging system in the delineation of Ill-defined basal cell carcinomas: a pilot study. JEADV 2019;33(1):71–8.
- 27
- Lindholm V, Raita-Hakola AM ym. Differentiating Malignant from Benign Pigmented or Non-Pigmented Skin Tumours-A Pilot Study on 3D Hyperspectral Imaging of Complex Skin Surfaces and Convolutional Neural Networks. J Clin Med. 2022;11(7):1914. doi:10.3390/jcm11071914
- 28
- Isoherranen K, Tolkki L, Salava A. Ihokoepalan otto ihotautien diagnostiikassa. Suom Lääkäril 2022;77: e30785 www.laakarilehti.fi/e30785.
- 29
- Lezcano C, Jungbluth A, Nehal K ym. PRAME Expression in Melanocytic Tumors. American J Surg Path 2018;42(11):1456–65.
- 30
- Lohman M, Steen A ym. The utility of PRAME staining in identifying malignant transformation of melanocytic nevi.J Cutan Pathol. 2021;48(7):856-862. J Cut Path 2021;48(7):856 –62.
- 31
- Harvey N, Peverall J, Acott N et al. Correlation of FISH and PRAME Immunohistochemistry in Ambiguous Superficial Cutaneous Melanocytic Proliferations. Am J Dermatopath 2021;43(12):913–20.
- 32
- Gassenmaier M, Hahn M ym. Diffuse PRAME Expression Is Highly Specific for Thin Melanomas in the Distinction from Severely Dysplastic Nevi but Does Not Distinguish Metastasizing from Non-Metastasizing Thin Melanomas. Cancers. 2021;13(15):3864.
- 33
- Tschandl P, Codella N, Akay B ym. Comparison of the accuracy of human readers versus machine-learning algorithms for pigmented skin lesion classification: an open, web-based, international, diagnostic study. Lancet Oncol 2019;20(7):938–47.
- 34
- Olsen T, Jackson B ym. Diagnostic Performance of Deep Learning Algorithms Applied to Three Common Diagnoses in Dermatopathology. J Path Inform 2018;9(32).
Diagnosis of cutaneous tumours
The diagnosis of cutaneous tumours is currently based on visual inspection of the skin lesions, dermoscopy and histopathological analysis of the skin samples. The relevant history including UV exposure, earlier dysplastic naevi and skin malignancies, immunosuppression and family history of skin tumours aids in evaluating the risk of cutaneous malignancies. Digital imaging and dermoscopy improve pathology reports. Recently, modern techniques such as reflectance confocal microscopy and optical coherence tomography have evolved to improve the noninvasive diagnosis of malignant lesions and to help in determining required surgical margins before operation. Combining dermoscopy and other non-invasive imaging methods with clinical findings reduces the need for biopsies. Digital microscopy, artificial intelligence and neural networks will come to play a more significant role in the future and will hopefully increase the diagnostic efficiency and accuracy for skin tumours, especially for rare and challenging neoplasms.
Hanna Siiskonen
M.D., Ph.D., M.Sc., resident in pathology
Specialist in dermatology and allergology
Department of Clinical Pathology, Kuopio University Hospital
Department of Pathology, Hospital Nova
Mari Salmivuori
M.D., Ph.D., specialist in dermatology and allergology
Skin and Allergy Hospital, Hus
Sari Koskenmies
Associate Professor, specialist in dermatology and allergology
Skin and Allergy Hospital, Hus
Leila Jeskanen
LL, specialist in pathology, dermatology and allergology
Department of Dermatopathology, Skin and Allergy Hospital, Hus
Katriina Lappalainen
LT, specialist in pathology, dermatology and allergology
Department of Dermatopathology, Skin and Allergy Hospital, Hus