Hedelmöityshoitojen mahdollisuudet
Hedelmöityshoidot suunnitellaan hedelmättömyyden syyn ja keston sekä naisen iän mukaan. Niistä saa avun 80 % pareista, kun naisen ikä on korkeintaan 35 vuotta.
Koeputkihedelmöityksessä joka neljäs yhden alkion siirto johtaa lapsen syntymään. Lasten perinataalituloksissa on pieniä eroja spontaanisti hedelmöityneiden lasten tilanteeseen.
Suomessa hedelmöityshoitoja saa sekä omilla että luovutetuilla sukusoluilla julkisilla ja yksityisillä klinikoilla.

Länsimaissa joka kuudes pari kokee tahatonta lapsettomuutta, eli raskaus ei ole alkanut vuoden yrittämisen jälkeen (1). Hoidoissa pyritään korjaamaan raskaaksi tulemista haittaavia tekijöitä.
Suomessa hedelmöityshoitojen toteutusta ja tarjontaa säätelevät Laki hedelmöityshoidosta (22.12.2006/1237), Laki ihmisen elimien, kudoksien ja solujen lääketieteellisestä käytöstä (astunut voimaan 2007) sekä lisäksi julkisella sektorilla yhtenäisen hoidon perusteet (2). Hedelmöityshoitolaki sallii omien sukusolujen ohella hoidot luovutetuilla munasoluilla, siittiöillä ja alkioilla.
Suomessa nais-miespareilla, naispareilla ja yksin lasta toivovilla naisilla on oikeus saada hedelmöityshoitoa. Miesparien hoitoa hedelmöityshoitolaki ei mahdollista. Sijaissynnytys on lain mukaan kielletty. Vuosittain hedelmöityshoitoja aloitetaan 13 000–14 000 ja hoidoista 17–18 % johtaa lapsen syntymään (3). Vuonna 2017 kaikista hedelmöityshoidoista 18,3 % eteni lapsen syntymään ja hoidoista syntyi 2 336 lasta. Tämä on arviolta 4,8 % kaikista syntyneistä lapsista (3).
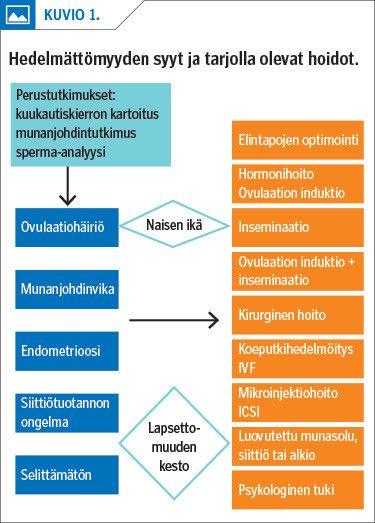
Hoito suunnitellaan aina yhdessä parin kanssa ja räätälöidään hedelmättömyyden syyn ja keston sekä naisen iän mukaan. Jos hedelmättömyyden syy on selittämätön tai hedelmättömyyden taustalla on lievä siemennestehäiriö, vähäinen (luokka I tai II) endometrioosi tai ovulaatiohäiriö, aloitetaan hoito usein ovulaation induktiolla ja inseminaatiolla (IUI). Tilanteen vaikeusasteen mukaan edetään koeputkihedelmöityshoitoon (IVF) tai lahjasukusoluhoitoihin (kuvio 1). Hedelmöityshoitolaki vaatii inseminaatio- ja koeputkihedelmöityshoitoon kirjallisen hoitosuostumuksen.
Ovulaation induktio
Ovulaatiohäiriöissä munarakkuloita kypsytetään joko tableteilla tai pistoksilla. Tavoitteena on kasvattaa 1–2 kypsää munarakkulaa. Mikäli munarakkuloita kehittyy liikaa, hoito keskeytetään tai edetään päivystykselliseen koeputkihedelmöitykseen.
Aiemmin paljon käytetty klomifeenisitraatti on nykyään Suomessa markkinoilla vain erityisluvalla. Sen tilalla käytetään myyntiluvasta poiketen letrotsolia, joka on rintasyövän hoidossa käytettävä aromataasin estäjä. Sen vaikutuksesta estrogeenin negatiivinen palautejärjestelmä aivolisäkkeeseen estyy ja gonadotropiinien eritys lisääntyy.
Letrotsolihoito aloitetaan yleensä annoksella 2,5 mg päivässä kierron päivinä 3–7. Virtsan LH-testillä varmistetaan ovulaatio ja ajoitetaan joko yhdynnät tai inseminaatio. Tarvittaessa annosta voidaan kasvattaa 7,5 mg:aan päivässä. Ovulaatio tapahtuu letrotsolilla noin 80 %:lle potilaista ja kolmasosa heistä tulee raskaaksi (4). Ovulaatio voidaan tarvittaessa ajoittaa istukkahormonilla (HCG).
Varsinkin ylipainoiset munasarjojen monirakkulaoireyhtymäpotilaat hyötyvät metformiinista, joka annoksella 1 500 mg/vrk voi palauttaa ovulatorisen kierron. Metformiini parantaa insuliiniherkkyyttä ja vaikuttaa edullisesti rasva-aineenvaihduntaan sekä edistää painonhallintaa. Annoksen suurentaminen vähitellen vähentää metformiinin aiheuttamia mahavaivoja. Metformiinin rinnalla voidaan käyttää letrotsolia (5).
Ovulaation induktio voidaan toteuttaa myös gonadotropiineilla. Follikkeleita stimuloiva hormoni (FSH), FSH:n ja luteinisoivan hormonin (LH) yhdistelmä tai ihmisen menopausaalinen gonadotropiini (hMG) aloitetaan pistoksina yleensä kuukautiskierron päivänä 5 ja hoitovasteen mukaan voidaan annosta tarvittaessa suurentaa. Ovulaatio laukaistaan istukkahormonilla. Potilaalle ohjeistetaan jatkoon yhdyntöjen ajoittaminen tai inseminaatio.
Loppukierron luteaalivaiheen tukeminen vaginaalisella progesteronilla näyttää lisäävän raskauden onnistumisen todennäköisyyttä gonadotropiinilla toteutetussa ovulaation induktiossa (6). Viime aikoina on yhä enemmän käytetty myös suun kautta annosteltavaa dydrogesteronia, joka on koeputkihedelmöityksessä osoittautunut tehokkaaksi luteaalitueksi (7). Luteaalituen hyödystä letrotsolihoidossa ei ole vielä riittävästi näyttöä (6).
Munarakkulan kypsytyshoidoissa 70–85 % raskauksista alkaa ensimmäisten kolmen hoitokierron aikana. Ovulaatiohäiriöstä kärsiville naisille ovulaation induktiokiertoja yhdistettynä inseminaatioon suositellaan jatkettavaksi yhteensä 4–6 kertaa, muille vain 3–4 kertaa (8,9). Selittämättömän hedelmättömyyden hoidossa kolmen gonadotropiinilla toteutetun ovulaation induktiokierron on todettu alle 38-vuotiailla naisilla hoitotuloksiltaan vastaavan yhtä koeputkihedelmöitystä (10).
Inseminaatiohoito
Inseminaatiossa (IUI) laboratoriossa pesukäsitellyt siittiöt viedään ovulaation aikoihin kohtuonteloon. Pesulla saadaan poistettua liikkumattomat ja kuolleet siittiöt, valkosolut, soludebris ja seminaaliplasma, jotka voivat haitata hedelmöitymistä. Inseminaatiolla ohitetaan kohdunkaulakanava, jolloin siittiöiden pääsy munasolun läheisyyteen helpottuu.
Yleensä 10–12 % inseminaatiokierroista johtaa lapsen syntymään (3). Parhaat raskausluvut ovat alle 38-vuotiailla naisilla (kuvio 2). Ennustetta parantavat naisen nuori ikä ja pesun jälkeen eteenpäin liikkuvien siittiöiden määrä yli 2,5 miljoonaa.
Inseminaatio on koeputkihedelmöitykseen nähden halpa ja potilaalle kevyt hoito (11).
Koeputkihedelmöityshoito
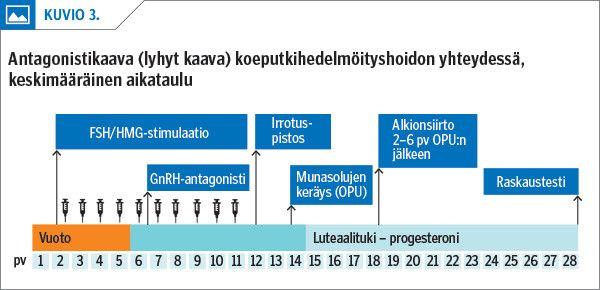
Koeputkihedelmöityshoito (IVF/ICSI) on tehokkain hoitovaihtoehto hedelmättömyyttä aiheuttavissa tilanteissa. Hormonihoidolla pyritään monirakkulaiseen vasteeseen ja hoito voidaan toteuttaa joko GnRH-agonistilla (pitkä hoitokaava) tai GnRH-antagonistilla (lyhyt hoitokaava; kuvio 3).
Pitkässä IVF-protokollassa munasarjatoiminta inaktivoidaan aluksi GnRH-agonistilla, jonka seurauksena gonadotropiini- ja estrogeenitasot laskevat. Kun munasarjat on saatu lepotilaan, munarakkuloiden stimulaatio aloitetaan FSH:lla, FSH/LH:lla tai hMG:llä. Vuonna 2019 julkaistun uuden ohjeistuksen mukaan kumpaa tahansa näistä gonadotropiineista voidaan yhtä hyvin suositella (12). Yleensä annos on 150–300 IU päivässä eikä sitä kannata stimulaation aikana suurentaa (12).
Antagonistihoidossa munarakkuloiden kasvatus aloitetaan kuukautiskierron alussa ja FSH/hMG-pistosten rinnalla käytetään GnRH-antagonistia, joka estää ennenaikaisen LH-erityksen. Molemmilla hoitokaavoilla syntyy lapsia yhtä hyvin. Antagonistihoidossa on kuitenkin noin puolet pienempi munasarjojen hyperstimulaatio-oireyhtymän (OHSS) riski (12). Antagonistihoitoa suositellaankin varsinkin nuorille, hoikille naisille, joilla munasarjareservi on suuri: paljon antraalisia follikkeleita ja suuri Müllerin tiehyitä surkastuttavan peptidin (AMH) taso (> 5 µg/l) (12). Eurooppalaisessa suosituksessa suositellaan antagonistihoitoa myös oletetun normaalin stimulaatiovasteen potilaille turvallisuussyistä. Sen sijaan huonon ennusteen potilaiden hoidossa voi käyttää yhtä lailla antagonistia tai agonistia (12). Adjuvantteja eli apuaineita, kuten kasvuhormonia, testosteronia ja asetyylisalisyylihappoa, ei voi suositella hoidon tehostamiseen (12).
Munasolujen kypsyminen varmistetaan HCG-pistoksella tai GnRH-agonistilla antagonistihoidossa. Munasolut kerätään 36–40 tunnin kuluttua kaikukuvausohjatulla punktiolla emättimen kautta. Ne hedelmöitetään laboratoriossa maljalla (IVF) tai mikroinjektiolla (ICSI) tuoreilla tai pakastetuilla siittiöillä. Alkioita viljellään 2–6 päivää, ja siirtoon valitaan yleensä laadultaan paras alkio.
Raskaustulokset
Kun nainen on alle 30-vuotias, yli 30 % alkionsiirroista johtaa synnytykseen (kuvio 2), mutta iän kasvaessa raskaustulokset heikkenevät. THL:n vuoden 2017 tilastojen mukaan kaikista koeputkihedelmöityksistä 20,5 % eteni lapsen syntymään ja noin viidesosa raskauksista menee kesken (3); spontaaniraskauksista keskeytyy keskimäärin 15 %.
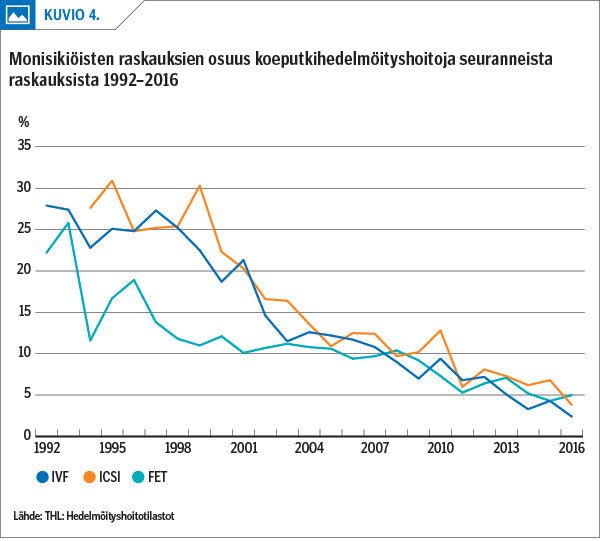
Suomessa on 2000-luvulta lähtien yhä useammin siirretty vain yksi alkio kerrallaan kohtuonteloon. Vuonna 2016 yli 80 % kaikista tuorealkionsiirroista oli yhden alkion siirtoja ja samalla hoidosta alkaneiden monisikiöraskauksien määrä on laskenut 5 %:iin (13) (kuvio 4). Hoidosta kehittyneet ylimääräiset hyvänlaatuiset alkiot pakastetaan, suurin osa blastokysteina eli 5–6 päivän ikäisinä (kuva 1).
Koeputkihedelmöitysten raskausluvut paranevat aluksi kerättyjen munasolujen määrän lisääntyessä ja parhaimmat ne ovat, kun munasoluja kerätään 15. Isommilla munasolumäärillä tulokset taas huononevat (14). Ensimmäisessä hoitokierrossa saatujen munasolujen määrä korreloi suoraan raskauslukuihin myös jatkossa (15).
Tanskalaisessa kohorttitutkimuksessa hedelmöityshoitoa saaneista pareista 57 % sai hoidolla viiden vuoden kuluessa lapsen ja 14 % tuli spontaanisti raskaaksi ja synnytti (16). Lapsen saannin mahdollisuus huononee naisen iän kasvaessa. Alle 35-vuotiaista naisista synnytti hoidon jälkeen 80 %, yli 40-vuotiasta naisista vain 26 %. Spontaanin raskauden ja synnytyksen todennäköisyys samoissa ikäryhmissä oli 16 % ja 10 % (16).
Riskit
Koeputkihedelmöityshoidon pelätyin haittavaikutus on munasarjojen hyperstimulaatio-oireyhtymä (OHSS), jossa munarakkuloita tai munasoluja tulee liikaa eli käytännössä yli 18 (12). Tyypillisiä oireita ovat vatsakipu, turvotus, pahoinvointi ja hengenahdistus. Hyperstimulaation kokonaisesiintyvyyden arvioidaan olevan 1–5 %. Antagonistihoitojen yleistyminen ja sen mukanaan tuoma mahdollisuus käyttää GnRH:ta munasolujen kypsyttämisessä HCG:n sijasta on viime vuosina huomattavasti pienentänyt riskiä. Tärkeintä on riskipotilaiden tunnistaminen, tuorealkionsiirrosta luopuminen ja kaikkien alkioiden pakastaminen, jos hyperstimulaatio uhkaa.
Munarakkulapunktiossa sekä verenvuodon että infektion riskit ovat pienet, alle 1 % (17). Altistavia tekijöitä ovat hankalat anatomiset olosuhteet, kuten kiinnikkeet, endometrioosi tai laajentunut munanjohdin. Kookkaat munasarjat voivat altistaa myös munasarjan kiertymälle, jonka esiintyvyys on arviolta alle 0,15 % (17).
Pakastetun alkion siirto
Alkioita voidaan pakastaa hitaalla tai nopealla menetelmällä. Yhä enemmän käytetään nopeaa pakastusmenetelmää eli vitrifikaatiota, jolla pakastetut alkiot selviytyvät sulatuksesta siirtoon yli 90 %:n todennäköisyydellä (18). Pakastetut sulatetut alkiot voidaan siirtää omaan ovulaatioon ajoitettuina, jos kuukautiskierto on säännöllinen. Jos kuukautiskierto on epäsäännöllinen, pakastetun alkion siirto (PAS) tehdään hormonikorvaus- tai ovulaation induktiokierrolla.
Hormonikorvauskierrossa aloitetaan kierron alussa estrogeenihoito suun kautta 4–6 mg päivässä tai ihon kautta estrogeenilaastari 100–150 µg kahdesti viikossa. Tällä lääkityksellä oma gonadotropiinineritys estyy ja munasarjat pysyvät lepotilassa. Tavoitteena on, että kohdun limakalvo on alkionsiirtopäivänä ainakin 8 mm:n paksuinen. Estrogeenin lisäksi progesteroni on välttämätön alkion kiinnittymiselle, ja hormonikorvaushoidossa sitä annetaan ainakin raskausviikolle 9 asti.
Suomessa nykyisin noin puolet koeputkihedelmöityksessä alkunsa saaneista lapsista syntyy pakastetun alkion siirron jälkeen (3). Raskauden todennäköisyys on hyvin samanlainen kuin tuorealkionsiirron jälkeen (19), ja tästä syystä tuorealkionsiirrosta luopumista ja kaikkien alkioiden pakastamista suositellaan herkästi munasarjojen hyperstimulaatio-oireyhtymän riskin minimoimiseksi (12,20).
Vaikeiden siemennestemuutosten hoito
Siemennesteen laatu on merkittävä tekijä hedelmättömyyden hoitomuotoa valittaessa. Usein tarvitaan mikroinjektiohoitoa (ICSI), mutta vaikeiden siemennestemuutosten taustatekijöiden selvittäminen on erityisen tärkeää, koska joissakin tilanteissa pelkkä miehen hoitaminen spermatogeneesiä indusoimalla voi mahdollistaa spontaanin raskauden.
Siittiöiden puuttuminen siemennesteestä jaetaan obstruktiiviseen (OA) ja ei-obstruktiiviseen atsoospermiaan (NOA). Obstruktiivisessa tilanteessa siittiötuotanto kiveksessä on normaalia, mutta siittiöiden kulkeutuminen siemennesteeseen on estynyt esimerkiksi anatomisen poikkeavuuden, toimenpiteen, tulehduksen tai trauman aiheuttaman tukoksen vuoksi. Siittiöitä on mahdollista hakea kiveksestä neulanäytteellä tai kiveksen mikrodissektioleikkauksella (MD-TESE). Ei-obstruktiivisessa tilanteessa siittiötuotanto on häiriintynyt. Taustalla voi olla aivolisäkkeen vajaatoiminta, geneettinen tekijä (esim. Klinefelterin oireyhtymä 47XXY, Y-deleetio), lääkehoito (solunsalpaajat, anaboliset steroidit) tai kivesvaurio. Hoitona voidaan käyttää etiologian mukaan vain spermatogeneesin induktiota lääkkein tai lääkehoidon ja kivesbiopsian tai mikrodissektioleikkauksen yhdistelmää (22).
Alkiodiagnostiikka erityistilanteissa
Alkioiden viljely blastokystivaiheeseen sekä parantuneet pakastusmenetelmät samanaikaisesti DNA-analyysimenetelmien kehittymisen kanssa ovat laajentaneet alkiodiagnostiikan (preimplantation genetic testing, PGT) käyttömahdollisuuksia. Alkiodiagnostiikkahoidot jaetaan kolmeen ryhmään: yhden geenin virheen aiheuttaman perinnöllisen sairauden takia tai rakenteellisen kromosomipoikkeavuuden vuoksi tehtäviin hoitoihin sekä hoitoihin, joissa seulotaan alkioiden kromosomilukumäärä (aneuploidiaseulonta).
Alkiodiagnostiikkahoito on vaihtoehto niille pareille, jotka haluavat välttää sikiödiagnostiikkaa mahdollisesti seuraavan raskaudenkeskeytyksen. Toistaiseksi nämä hoidot on julkisessa terveydenhuollossa rajattu koskemaan vain vaikeita ja yleensä jo lapsuusiässä ilmeneviä tauteja. Alkiodiagnostiikkaan liittyy monenlaisia eettisiä kysymyksiä ja moniammatillinen yhteistyö sekä potilaiden riittävä neuvonta sekä genetiikan että hedelmöityshoitojen asiantuntijoiden toimesta ovat välttämättömiä (22).
Hedelmöityshoidot luovutetuilla sukusoluilla
Hedelmöityshoidossa voidaan käyttää luovutettuja sukusoluja, jos omat sukusolut puuttuvat tai niiden laatu on huono. Luovutettuja siittiöitä käytetään lisäksi naisparien ja yksin lasta toivovien naisten hoidossa. Suomessa on käytetty luovutettuja siittiöitä jo 1980-luvulla ja luovutettuja munasoluja ja alkioita 1990-luvun alusta.
Vuonna 2017 Suomessa hedelmöityshoidoista 18 % tehtiin luovutetuilla sukusoluilla. Hoidot on aiemmin tehty lähes yksinomaan yksityisillä hedelmöityshoitoklinikoilla (3), mutta vuonna 2019 julkinen sektori päätti aloittaa kaikissa yliopistosairaaloissa hoidot luovutetuilla soluilla eri potilasryhmille, myös naispareille ja yksin lasta toivoville naisille. Taustalla ovat tasa-arvovaltuutetun suositus, STM:n kirjeet ja tiedotteet yhdenvertaisuuden tärkeydestä hedelmöityshoitojen tarjonnassa sekä päivitetyt Yhtenäisen hoidon kriteerit (2).
Syy sukusolujen puuttumiseen tai toimimattomuutteen saattaa liittyä geneettiseen poikkeavuuteen tai syövän hoitoon. Ennenaikaisesti hiipuvan munasarjatoiminnan (POI) taustalla voi olla aiemmin esimerkiksi endometrioosin tai kasvaimen vuoksi tehty munasarjojen leikkaus, mutta monesti etiologia jää nykyisillä tutkimusmenetelmillä tuntemattomaksi (23). Luovutettujen alkioiden käyttö on vaihtoehto, jos epäillään tai todetaan sekä munasolu- että siittiöperäistä vikaa.
Suomen hedelmöityshoitolain mukaan sukusoluja voi luovuttaa täysi-ikäinen henkilö, joka on hyväksytty terveystarkastuksessa. Hänen lähisuvussaan ei saa olla vakavia perinnöllisiä sairauksia. Pari, jolla on jäljellä itselle tarpeettomia omista sukusoluista syntyneitä pakastettuja alkioita, voi luovuttaa ne toiselle parille tai henkilölle.
Sukusolujen luovuttaja on yleensä vastaanottajalle tuntematon, mutta hän voi myös olla saajalle tunnettu henkilö, esimerkiksi ystävä tai sisko. Luovuttajan pitää suostua siihen, että hänen henkilötietonsa ilmoitetaan Valviran ylläpitämään kansalliseen luovuttajarekisteriin (Luoteri). Luovutetusta sukusolusta tai alkiosta alkunsa saanut henkilö voi täysi-ikäisenä saada rekisteristä tiedon luovuttajan henkilöllisyydestä. Edellytys tähän on, että vanhemmat ovat kertoneet lapselle, miten hän on saanut alkunsa.
Raskaustulokset
Luovutettua munasolua käytettäessä synnytyksen todennäköisyys on hyvä, keskimäärin 25–30 % alkionsiirtoa kohden, kun kohtuun siirretään yksi alkio kerrallaan (24). Tuloksiin vaikuttavat ennen kaikkea luovuttajan ikä ja munasolujen laatu, ja ne ovat samat vastaanottajien ikäryhmissä ainakin 45 ikävuoteen asti (25).
Vuonna 2017 Suomessa 13 % inseminaatioista ja 30 % koeputkihedelmöityksistä luovuttajan siittiöillä johti lapsen syntymään (3).
Koeputkihedelmöityksestä syntyneiden lasten terveys
Monisikiöraskauksien vähentyminen on pienentänyt perinataaliriskejä ja johtanut koeputkihedelmöityksestä syntyneiden lasten parempaan terveyteen. Kuitenkin myös yksisikiöisissä IVF-raskauksissa syntyneillä lapsilla on kohonnut pienipainoisuuden ja ennenaikaisuuden riski sekä lievästi suurentunut epämuodostumariski spontaanialkuisiin lapsiin verrattuna (26,27). Toisaalta pakastetun alkion siirron jälkeen syntyneellä lapsella on lisääntynyt riski syntyä isokokoisena verrattuna tuorealkionsiirron jälkeen syntyneisiin (28,29).
Syitä koeputkihedelmöityksestä syntyneiden lasten lievästi erilaisiin perinataalituloksiin verrattuna spontaanisti alkunsa saaneisiin ei varmuudella tiedetä. Niiden oletetaan liittyvän ennen kaikkea vanhempien terveys- ja hedelmättömyystaustaan. Toisaalta koeputkihedelmöitys- ja mikroinjektiohoitoon liittyvät kliiniset ja laboratoriotekniset tapahtumat saattavat myös vaikuttaa alkion varhaiseen kehitykseen ja heijastua lapsen lyhyt- ja pitkäaikaiseen terveyteen (26,27). Hormonikorvauskierrolla tuettu pakastetun alkion siirto näyttää lisäävän pre-eklampsian ja istukkakomplikaatioiden riskiä verrattuna luonnollisessa kierrossa tehtyyn alkionsiirtoon (30).
Lopuksi
Monet tekijät, kuten syövän ja monien muiden sairauksien hoito, voivat vaarantaa hedelmällisyyttä. Lisäksi perhettä ryhdytään suunnittelemaan aiempaa vanhemmalla iällä, jolloin tahattoman lapsettomuuden riski kasvaa (31). Nykyisin on mahdollista pakastaa alkioita, munasoluja, siittiöitä tai munasarjakudosta tulevaisuutta ajatellen, ja näille toimenpiteille on yhä enemmän kysyntää (32,33). Terveydenhuollon ammattilaisten tulisi ottaa hedelmällisyyteen liittyvät asiat puheeksi ja tarjota aktiivisesti mahdollisuutta neuvontaan, jotta voitaisiin pohtia hedelmällisyyden säilyttämiseen pyrkiviä toimenpiteitä niille, jotka sitä toivovat ja joiden tilanteessa se on mahdollista.
Suomessa voidaan tarjota monipuolisesti hedelmöityshoitoja. Hoidon ulkopuolelle ovat jääneet vain ne noin 1 000 hedelmällisessä iässä olevaa naista, joilla lapsettomuus on kohtuperäinen, sekä miesparit. Ei-kaupallisen sijaissynnytyksen sallimisen selvittäminen on hallitusohjelmassa. Myös kohdunsiirtojen mahdollisuutta pohditaan (34).
Eini Nikander: Matka-, majoitus- ja kokouskulut (Gedeon Richter).
Tiina Koskela-Koivisto: Ei sidonnaisuuksia.
Viveca Söderström-Anttila: Luentopalkkiot (Ferring, Merck), matka-, majoitus- ja kokouskulut (Gedeon Richter).
- 1
- Evers JL. Female subfertility. Lancet 2002;360:151–9.
- 2
- STM. Yhtenäisen hoidon kriteerit https://stm.fi/julkaisu?pubid=URN:ISBN:978-952-00-4036-9
- 3
- Terveyden ja hyvinvoinnin laitos/tilastot. www.thl.fi/fi_FI/web/fi/tilastot/aiheittain
- 4
- Franik S, Eltrop SM, Kremer JAM, Kiesel L, Farquhar C. Aromatase inhibitors (letrozole) for subfertile women with polycystic ovary syndrome. Cochrane Database Syst Rev 2018(5):CD010287
- 5
- International evidence-based guideline for the assessment and management of polycystic ovary syndrome. https://www.monash.edu/medicine/sphpm/mchri/pcos/guideline
- 6
- Green KA, Zolton JR, Schermerhorn SMV ym. Progesterone luteal support after ovulation induction and intrauterine insemination: an updated systematic review and meta-analysis. Fertil Steril 2017;107:924–33.
- 7
- Griesinger G, Blockeel C, Sukhikh GT ym. Oral dydrogesterone for luteal phase support in fresh in vitro fertilization cycles: a new standard? Fertil Steril 2018;109:756–62.
- 8
- Morin-Papunen L, Koivunen R. Hedelmättömyyden hoidot - osa I. Duodecim 2012;128:1478–85.
- 9
- Cohlen B, Bijkerk A, Van der Poel S, Ombelet W. IUI: review and systematic assessment of the evidence that supports global recommendations. Hum Reprod Update 2018;24:300–19.
- 10
- Nandi A, Bhide P, Hooper R, Gudi A, Shah A, Khan K, Homburg R. Intrauterine insemination with gonadotropin stimulation or in vitro fertilization for the treatment of unexplained subfertility: a randomized controlled trial. Fertil Steril 2017;107:1329–35.
- 11
- Kandavel V, Cheong Y. Does intra-uterine insemination have a place in modern ART practice? Best Pract Res Clin Obstet Gynaecol 2018;53:3–10.
- 12
- ESHRE Reproductive Endocrinology Guideline Group. Ovarian stimulation for IVF/ICSI. Guideline of the European Society of Human Reproduction and Embryology 2019.
- 13
- Tiitinen A. Single embryo transfer: Why and how to identify the embryo with the best developmental potential. Best Pract Res Clin Endocrinol Metab 2019;33:77–88.
- 14
- Sunkara SK, Rittenberg V, Reine-Fenning N, Bhattacharya S, Zamora J, Coomarasamy A. Association between the number of eggs and live birth in IVF treatment: an analysis of 400 135 treatment cycles. Hum Reprod 2011;26:1768–74.
- 15
- Malchau SS, Henningsen AA, Forman J, Loft A, Nyboe Andersen A, Pinborg A. Cumulative live births rate prognosis based on the number of aspirated oocytes in previous ART cycles. Hum Reprod 2019;34:171–80.
- 16
- Malchau SS, Henningsen AA, Loft A ym. The long-term prognosis for live birth in couples initiating fertility treatments. Hum Reprod 2017;32:1439–49.
- 17
- Tuominen M, Tiitinen A. Lapsettomuushoitojen komplikaatiot. Suom Lääkäril 2017;72:1845–9.
- 18
- Magdi Y, El-Damen A, Fathi AM ym. Revisitng the management of recurrent implantation failure through freeze-all policy. Fertil Steril 2017;108:72–7.
- 19
- Shapiro BC, Daneshmand ST, Restrepo H, Garner FC, Aguirre M, Hudson C. Matched-cohort comparison of single-embryo transfers in fresh and frozen-thawed embryo transfer cycles. Fertil Steril 2013;99:389–92.
- 20
- Vuong LN, Pham TD, Dang VQ ym. Live birth rates with a freeze-only strategy versus fresh embryo transfer: secondary analysis of a randomized clinical trial. Reprod Biomed Online 2019;38:387–96.
- 21
- Klami R, Mankonen H, Perheentupa A. Siittiöitä suoraan kiveksestä? Duodecim 2018;134:1897–903.
- 22
- Hyden-Granskog C, Anttonen A-K, Tiitinen A. Alkiodiagnostiikan nykytilanne Duodecim 2018;134:2189–96.
- 23
- Oksjoki S, Jokimaa V. Munasarjojen toiminnan ennenaikainen hiipuminen – uhka naisen terveydelle? Duodecim 2015;131:136–42.
- 24
- Sälevaara M, Söderström-Anttila V. Raskaus lahjoitetusta munasolusta – ainutlaatuinen mahdollisuus mutta vaikuttaako vieras munasolu raskauden ennusteeseen? Duodecim 2018;134:53–9.
- 25
- Yeh JS, Steward RG, Dude AM, Shah AA, Goldfarb JM, Muasher SJ. Pregnancy outcomes decline in recipients over age 44: an analysis of 27,959 fresh donor oocyte in vitro fertilization cycles from the Society for Assisted Reproductive Technology. Fertil Steril 2014;101:1331–6.
- 26
- Kaartinen N, Tinkanen H. Syntyykö koeputkihedelmöityshoidoilla terveitä lapsia. Duodecim 2017;133:728–34.
- 27
- Berntsen S, Söderström-Anttila V, Wennerholm UB ym. The health of children conceived by assisted reproductive technology (ART). “The chicken or the egg?” Hum Reprod Update 2019;2:137–58.
- 28
- Pelkonen S. Koivunen R, Gissler M ym. Perinatal outcome of children born after frozen and fresh embryo transfer: the Finnish cohort study 1995-2006.Hum Reprod 2010;25:914–23.
- 29
- Maheshwari A, Pandey S, Amalraj Raja E, Shetty A, Hamilton M, Bhattacharaya S. Is frozen embryo transfer better for mothers and babies? Can cumulative meta-analysis provide a definitive answer? Hum Reprod Update 2018;24:35–58.
- 30
- Saito K, Kuwahara A, Ishikawa T ym. Endometrial preparation methods for frozen-thawed embryo transfer are associated with altered risks of hypertensive disorders of pregnancy, placenta accreta, and gestational diabetes mellitus. Hum Reprod 2019;34:1567–75.
- 31
- Roustaei Z, Räisänen S, Gissler M, Heinonen S. Fertility rates and the postponement of first births: a descriptive study with Finnish population data. BMJ Open 2019; 9:e026336.
- 32
- Pakarinen P, Varpu R. Hedelmällisyyden säilyttäminen gynekologisen syövän hoidossa. Suom Lääkäril 2018;73:844–8.
- 33
- Söderström-Anttila V. Ennakoiva munasolupakastus. Suom Lääkäril 2014;69:1711–5.
- 34
- Mäkisalo H, Heikinheimo O, Savolainen-Peltonen H, Sallinen V. Vieraalla kohdulla äidiksi. Duodecim 2019;135:2409–13.
Fertility treatments today
In Western countries, every sixth couple suffers from involuntary infertility. Fertility treatment is tailored to the specific reason for infertility. Fertility treatments include surgical procedures, ovulation induction, and assisted fertility treatments, such as insemination, in vitro fertilization (IVF) and microinjection (ICSI). In Finland, treatments with donated oocytes, sperm and embryos are also allowed.
The success rate of standard IVF is strongly related to the age of the women. More than 30% of all embryo transfers (ETs) will lead to a live birth if the woman is less than 30 years old. Of all assisted fertility treatments performed in Finland in 2017, 18.3% resulted in a live birth (2336 children).
In Finland, more than 80% of all ETs are single embryo transfers and the multiple rate is less than 5% of all deliveries. This has a favourable effect on the perinatal outcome and health of the children born. The success rate is similar after ET of fresh and frozen embryos, and half of the children are born after frozen-thawed ET. Preimplantation genetic testing (PGT) can be used to diagnose structural chromosomal abnormalities or hereditary genetic diseases in the developing embryos.
Donated gametes can be used in cases where the patient´s own oocytes or sperm are lacking or have too low quality to produce an on-going pregnancy. The success rate after oocyte donation treatment is 35–40% and is not dependent on the age of the recipient up to the age of 45 years. The live birth rate after donor insemination is 10–15% depending on the age of the woman.