Gynekologisen syövän robottiavusteinen kirurgia
• Robottiavusteinen tähystyskirurgia soveltuu erinomaisesti gynekologisten syöpien leikkaushoitoon.
• Merkittävin kohderyhmä on suuren riskin kohdunrunkosyöpä.
• Suomessa robottiavusteista leikkaustekniikkaa on käytetty gynekologiassa kymmenen vuoden ajan. Se on osoittautunut tehokkaaksi ja turvalliseksi.
• Suhteellisen suurten kustannusten vastapainona on ollut vaativien leikkausten hyvä onnistuminen.

Robottiavusteinen kirurgia on uutta tähystyskirurgiaa, joka hyväksyttiin lääketieteen käyttöön vuonna 2005. Tämän jälkeen sen käyttö on levinnyt nopeasti ja maailmanlaajuisesti.
Ensin robottiavusteinen kirurgia yleistyi eturauhassyöpäleikkauksissa, mutta viime vuosina sitä on alettu hyödyntää erityisesti gynekologian ja gastrokirurgian aloilla. Robottiavusteista laparoskopiaa käytetään myös thorax- ja verisuonikirurgiassa, lastenkirurgiassa sekä korva-, nenä- ja kurkkutaudeissa. Hiljattain myös tyriä leikkaavat kirurgit ovat kiinnostuneet robottikirurgian mahdollisuuksista.
Suomessa tekniikkaa alettiin hyödyntää urologiassa joulukuussa 2008 ja gynekologisissa leikkauksissa v. 2009 Tampereella ja Helsingissä. Kuluneen kymmenen vuoden aikana TAYS:ssa on tehty noin tuhat gynekologista robottileikkausta, joista suurin osa gynekologisten syöpien vuoksi. Tätä nykyä tekniikka on käytössä kaikissa Suomen viidessä yliopistollisessa sairaalassa.
Robottikirurgiassa on tähän saakka ollut käytössä Intuitive Surgical -yhtiön leikkausrobotti Da Vinci. Ensimmäisen mallin jälkeen on ehtinyt tulla Suomessakin käyttöön kaksi päivitettyä versiota, joista viimeisimpänä Da Vinci Xi. Robotteja on todennäköisesti tulossa markkinoille muiltakin yhtiöiltä. Kilpailun toivotaan pienentävän robottikirurgian suuria kustannuksia.
Robottiavusteisen ja perinteisen laparoskopian suurin ero on se, että robottikirurgiassa leikkaava kirurgi ei ole potilaan vierellä käsin kiinni vatsaonteloon viedyissä instrumenteissa, vaan siirtää käsiensä liikkeen instrumentteihin tietokoneen välityksellä.
Robottiavusteiseen tekniikkaan tarvitaan kolme komponenttia: konsoli, robotti ja optiikka (kuva 1). Potilaan vatsanpeitteisiin asetetaan troakaaria, ja robottikäsivarret kiinnitetään niihin. Keskimmäiseen robottikäsivarteen kiinnitetään kamera, muihin kolmeen kirurgisia työskentelyinstrumentteja. Yleisimmät instrumentit ovat sakset, polttopihti ja pitopihti, jotka viedään potilaan vatsaonteloon.
Leikkaava lääkäri ohjaa robotin toimintaa konsolissa istuen. Potilaaseen kiinnitettyjä robottikäsivarsia ja instrumentteja liikutetaan joystick-tyyppisillä käsiohjaimilla ja jalkapolkimilla polkemalla (kuva 2). Käytettävä sähkövirta valitaan konsolista jalkapolkimilla. Kameran optiikkaa ja vatsaontelon kaasua säädetään ns. laparoskopiatornista (1,2).
Robottiavusteisen tekniikan edut ja haitat
Robottiavusteisessa kirurgiassa on erityspiirteitä, joita muissa leikkausmenetelmissä ei ole. Kirurgisten instrumenttien kärjet ovat pieniä ja liikkuvat moneen suuntaan. Instrumentin liikutteluun voidaan välittää ranteen liikerata, joka muistuttaa kirurgin käden liikettä avoleikkauksessa, mutta pienemmässä mittakaavassa: 6 cm:n ranneliike vastaa 2 cm:n liikettä robottikäsivarren instrumentissa. Kirurgilla on konsolissa erittäin hyvä 3D-näkymä, jolloin kudosten ja etäisyyksien hahmottaminen on tarkkaa ja silmän ja käden yhteistyö helppoa. Ylimääräinen häiriöliike, kuten kirurgin käden vapina, suodattuu pois, ja myös kamera pysyy vakaasti halutussa asennossa (1,3).
Kolmiulotteinen näkymä yhdistettynä kirurgin jo aiemmin avoleikkauksissa käyttämään ranneliikkeeseen helpottavat oppimista. Useimmissa tutkimuksissa arvioidaan, että robottiavusteisen laparoskopian oppimiskäyrän pituus gynekologisissa syöpäleikkauksissa on 10–20 leikkausta (4,5). Kohdunrunkosyövän leikkauksissa se on suomalaisaineiston perusteella vain 10 leikkausta (6).
Arvioidaankin, että perinteiseen tähystyskirurgiaan verrattuna robottiavusteisen tekniikan oppiminen on nopeampaa esim. laparoskooppisessa ompelemisessa. Perinteiseen laparoskooppiseen kirurgiaan verrattuna robottiavusteisen laparoskopian oppimiskäyrä on noin kaksi kertaa jyrkempi (49 vs. 24 leikkausta) (7).
Kirurgin leikkausasento on konsolissa työskennellessä melko ergonominen (3,8,9). Tästä huolimatta monet kirurgit (56 %) ilmoittavat kyselytutkimuksessa konsolityöskentelyyn liittyvistä poikkeavista fyysisistä oireista kuten niskajäykkyydestä, alaselkäkivusta, sormien väsymisestä ja silmien oireista (10). Samoin robottikäsivarsien liikettä väistelevän assistentin työasennot ovat ajoittain epäergonomiset (11).
Robottiavusteisessa kirurgiassa menetetään käsin kosketeltava kudostuntuma (12). Robottikäsivarsia ja -instrumentteja on myös kömpelöä liikutella laajoilla leikkausalueilla. Lisäksi leikkausasento voi olla haastava potilaalle. Potilas on Trendelenburgin asennossa, eli makaa selällään pää alempana kuin lantio, ja potilaan terveydentilan tulee kestää asentoa koko leikkauksen ajan (1).
Leikkaushoidon vaihtoehtoja gynekologisissa syövissä
Gynekologisessa syöpäkirurgiassa voidaan käyttää perinteistä avoleikkausta, emättimen kautta avustettua leikkausta, tähystysleikkausta ja uusimpana vaihtoehtona robottiavusteista tähystysleikkausta. Syövän koko ja sijainti vaikuttavat leikkaustavan valintaan.
Munasarjasyövässä valinta on lähes aina avoleikkaus tuumorin ison koon tai syövän levinneisyyden vuoksi. Ulkosynnyttimien syöpäleikkaus on luontevaa tehdä alatieleikkauksena ja emättimen syöpäleikkaus joko emättimen kautta, tähystysleikkauksena tai avoleikkauksena. Kohdunrunkosyövässä ja kohdunkaulan syövässä laparoskopia on sen sijaan merkittävässä roolissa. Perinteisiä tähystysleikkauksia tehdään edelleen paljon, mutta vaativissa tilanteissa robottiavusteiset leikkaukset ovat toinen tähystyskirurginen vaihtoehto.
Robottiavusteisessa kirurgiassa korostuvat laparoskopian hyvät puolet. Niitä ovat vähäinen verenvuoto leikkauksessa, pienentynyt komplikaatioriski, nopeampi toipuminen toimenpiteestä ja näin ollen myös lyhyempi sairaalassa oloaika ja lyhyempi sairausloman tarve (2,7,13).
Robottiavusteisen kirurgian käyttö gynekologisessa onkologiassa
Robottiavusteinen tähystysleikkaus tuo etuja perinteiseen tähystyskirurgiaan verrattuna, parantaa kirurgian laatua ja sopii erityisen hyvin kohdunrunkosyövän, kohdunkaulan syövän ja tietyissä tilanteissa alkuvaiheen munasarjasyövän hoitoon (14). Näistä merkittävin kohderyhmä on suuren riskin kohdunrunkosyövän leikkaushoito, ja Suomessa arviolta kahdeksan kymmenestä gynekologisesta robottileikkauksesta tehdään kohdunrunkosyövän vuoksi (15).
Kohdunrunkosyöpä
Kohdunrunkosyöpä (eli endometriumkarsinooma) sijaitsee kohdun limakalvolla ja kasvaa useimmiten myös kohdun lihaskerrokseen. Suomessa kohdunrunkosyöpä todettiin 920 naisella vuonna 2018. Sairastuvuus lisääntyy 65 ikävuoden jälkeen.
Kohtuverenvuoto on syövän ensioireena 90 %:lla potilaista. Siksi syöpä löydetään yleensä alkuvaiheessa ja pystytään hoitamaan parantavasti. Viiden vuoden suhteellinen elossaololuku oli 81 % vuosina 2016–18 (16).
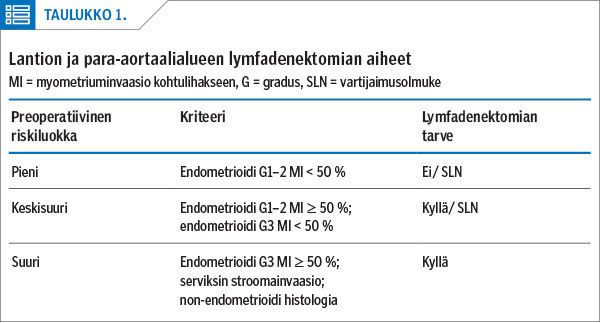
Kirurgia on kohdunrunkosyövän hoidon perusta. Leikkaussuunnitelma tehdään yksilöllisesti riskiluokan mukaan. Syövän ennustetekijöiden perusteella kohdunrunkosyöpä jaetaan pienen, keskisuuren tai suuren riskin luokkaan, joista robottikirurgialla hoidetaan keskisuuren ja erityisesti suuren riskin tautia (taulukko 1). Preoperatiivisen riskiluokan määrittämisen tavoitteena on valita potilaalle sopivin leikkauslaajuus yli- ja alihoitoa välttäen.
Tärkeää on myös löytää ne potilaat, joiden syöpä on voinut levitä kohdun ulkopuolelle ja jotka näin ollen tarvitsevat leikkauksen jälkeen liitännäishoitoja, esim. sytostaatti- tai sädehoitoa. Nämä potilaat tarvitsevat gynekologisten elinten poiston lisäksi laajemman levinneisyysleikkauksen (17,18,19).
Riskiluokan arvioimisessa käytetään kohdun endometriumnäytettä (pipelle) histologian selvittämiseksi, kaikututkimusta ja/tai magneettikuvausta syövän määrän ja myometriuminvaasion määrittämiseksi sekä TT-tutkimusta sen arvioimiseksi, missä määrin syöpä on levinnyt imusolmukkeisiin ja vatsaonteloon. Paras tulos saadaan yhdistämällä kyseiset tutkimukset. Tulevaisuudessa kohdunrunkosyövän genetiikka tulee yhä useammin toimimaan ennustetekijänä mahdollistaen yksilöllisemmän syövän hoidon suunnittelun (17).
Suuremman levinneisyysriskin syövässä laajempi leikkaus sisältää kohdun, munasarjojen ja munatorvien poiston lisäksi lantion ja para-aortaalialueen imusolmukkeiden poiston, seroosissa histologiassa myös vatsapaidan poistamisen. Keskisuuressa riskiluokassa potilaalle voidaan tehdä kyseinen laajempi leikkaus tai vaihtoehtoisesti vartijaimusolmuketutkimus.
Pienen riskin taudissa todennäköisyys syöpäsolujen leviämiseen kohdun ulkopuolelle on vain pari prosenttia. Tällöin leikkaushoito on suppeampi: kohdun, munasarjojen, munatorvien ja mahdollisesti vartijaimusolmukkeen poistaminen (20).
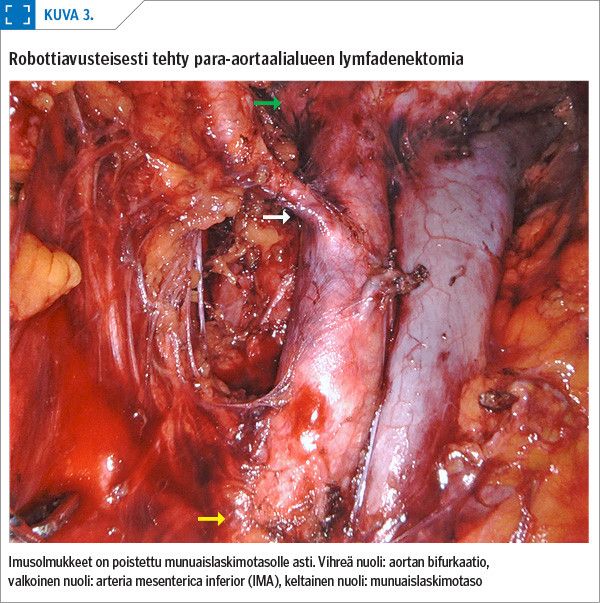
Imusolmukkeiden poistaminen laparoskopiassa on vaativa toimenpide. Robottiavusteinen kirurgia soveltuu hyvin siihen, erityisesti imusolmukkeiden poistamiseen para-aortaalialueelta.
Robottiavusteisessa kirurgiassa saadaan poistettua imusolmukkeet munuaislaskimotasolle asti paremmin kuin perinteisessä laparoskopiassa (kuva 3) (21,22,23). Tätä tukee suomalainen gynekologisten syöpäpotilaiden aineisto, joka kerättiin retrospektiivisesti seitsemän vuoden ajalta. Para-aortaalialueen imusolmukkeiden poisto onnistui arteria mesenterica inferiorin (IMA) ja munuaislaskimotason väliltä 83 %:ssa robottileikkauksista (15). Para-aortaalialueen imusolmukkeiden poisto onkin usein painava syy valita leikkaustavaksi robottiavusteinen kirurgia.
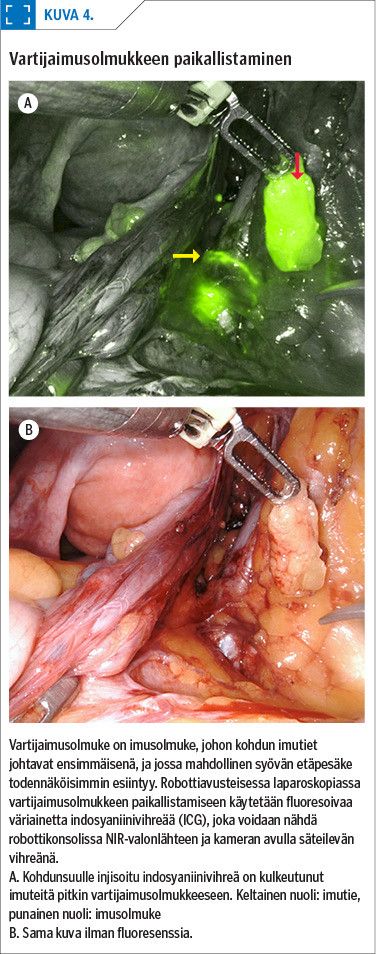
Imusolmukkeita ei haluta poistaa rutiinisti kaikilta potilailta, koska toimenpiteellä on myös haittavaikutuksia, esim. riski jalkojen lymfedeemaan. Toistaiseksi suuren riskin potilaille on tehty täydellinen lymphadenektomia, mutta tulevaisuudessa vartijaimusolmuketutkimus voi mahdollisesti ainakin osalla potilaista korvata sen (24) (kuva 4).
Kohdunrunkosyöpää sairastavat naiset ovat usein ylipainoisia, mikä hankaloittaa tähystysleikkauksia. On todettu, että robottiavusteisista tähystysleikkauksista joudutaan konversioon eli siirtymään avoleikkaukseen harvemmin kuin perinteisistä tähystysleikkauksista. Näin ollen ylipainoisille potilaille voidaan valita robottiavusteinen leikkaustapa myös sen turvallisuuden ja käyttökelpoisuuden vuoksi (25).
Kohdunkaulan syöpä
Suomessa todettiin 169 uutta kohdunkaulan syöpää (eli cervixkarsinoomaa) vuonna 2018. Tyypillisiä oireita ovat vuotohäiriöt ja yhdynnän jälkeinen verenvuoto. Papa-näytteellä pyritään löytämään kohdunkaulan syövän esiasteita, ja esiastemuutosten hoidolla voidaan ehkäistä niiden kehittyminen syöväksi. 50 vuotta sitten alkaneilla papa-seulonnoilla on pystytty enemmän kuin puolittamaan uusien syöpien ilmaantuminen (16,26).
Kohdunkaulan syövän riskitekijänä ovat suuren riskin papilloomavirukset (HPV) (27). HPV-papa-testi onkin herkempi löytämään solumuutokset, ja sen käyttö on tehokasta seulonnassa (28). Tupakointi on riskitekijä, joka yhdessä suuren riskin viruksen kanssa moninkertaistaa pahanlaatuisten muutoksien kehittymisen vaaran. Tulevaisuudessa HPV-rokotteen uskotaan vähentävän syövän ilmaantuvuutta. Se otettiin Suomessa rokotusohjelmaan 12-vuotiaille tytöille vuonna 2013 ja syksystä 2020 alkaen myös pojille (29).
Toteamisvaiheessa syöpä voi olla vain millimetrien kokoinen. Toisaalta se voi olla myös useita senttejä ja näkyä kohdunsuulla selvänä kasvaimena. Noin puolet uusista syöpätapauksista löydetään syövän ollessa paikallinen, jolloin se voidaan hoitaa leikkauksella. Löytyminen alkuvaiheessa parantaa selvästi ennustetta. Viiden vuoden suhteellinen elossaololuku oli 71 % vuosina 2016–2018 (16).
Kohdunkaulan ulkopuolelle levinnyt syöpä hoidetaan kemosädehoidolla ja brakyterapialla, johon tarvittaessa liitetään kudoksensisäinen sädehoito. Laajasti levinnyt syöpä hoidetaan solunsalpaajahoidolla.
Sen, kuinka laaja leikkaus tarvitaan, ratkaisevat syövän koko, sijainti ja potilaan ikä. Leikkaushoidon valintaan vaikuttaa myös raskaustoive, sillä monet sairastuneet ovat vielä fertiili-iässä. Leikkaustapa-arviota varten otetaan lantion magneettikuva, jolla arvioidaan syövän kokoa ja levinneisyyttä kohdunkaulan ulkopuolelle parametrioihin. Samoin tehdään PET-TT-kuvaus, jolla arvioidaan kaukolevinneisyyttä.
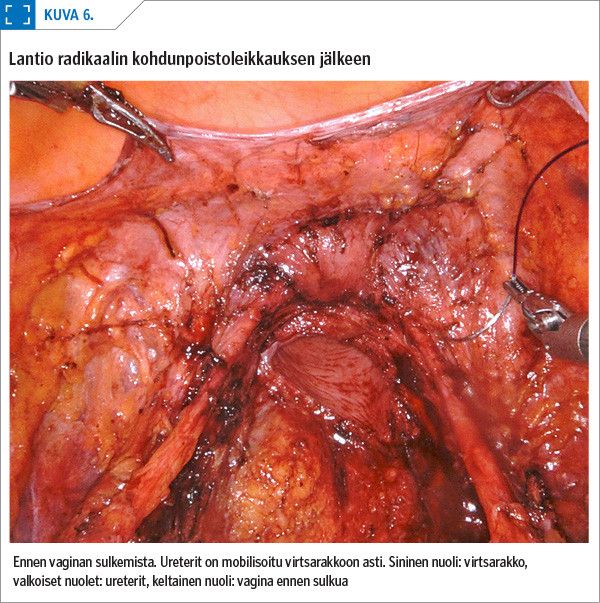
Operatiivinen hoito on kevyimmillään kohdunsuun sähkösilmukkahoito tai yksinkertainen kohdunpoisto. Radikaali kohdunpoisto (Wertheimin leikkaus), lantion ja presakraalialueen imusolmukkeiden poisto sekä vartijaimusolmuketutkimus tehdään, jos syövän invaasio on 0,5 cm tai enemmän, mutta syöpä rajoittuu edelleen kohdunkaulan alueelle. Vaihdevuodet ohittaneilta naisilla poistetaan adneksit, nuoremmilta naisilta ne poistetaan harkinnan perusteella (30,19).
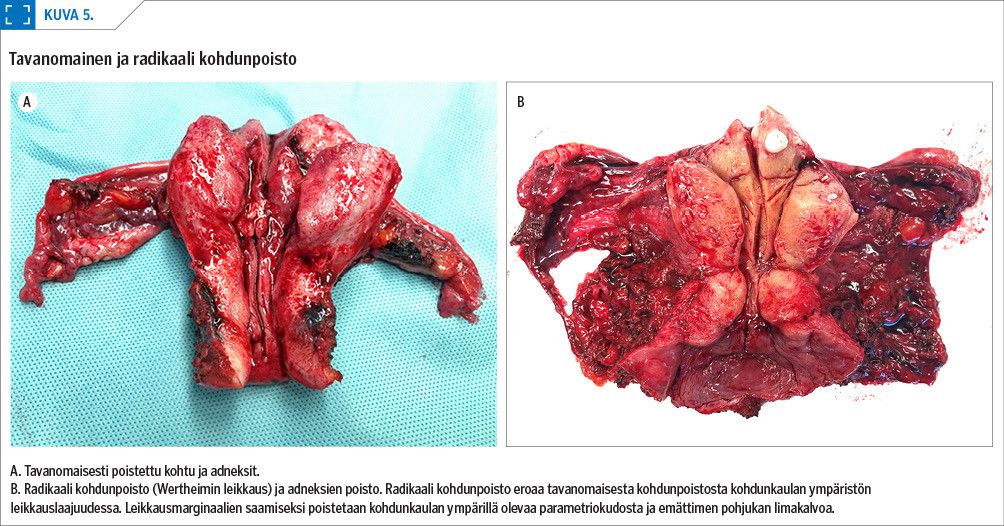
Radikaalissa kohdunpoistossa ureterit joudutaan mobilisoimaan virtsarakkoon asti, jotta parametriot vapautuvat poistettaviksi. Virtsarakkoa irrotetaan laajasti, jotta emättimen pohjukan limakalvoa saadaan poistettua kohdun mukana (kuva 5). Tällöin virtsarakon hermotuksen vaurioitumisen sekä komplikaatioiden riskit ovat suuremmat kuin tavanomaisessa kohdunpoistossa. Postoperatiivisesti potilaalla voi olla enemmän virtsaamisvaikeuksia ja mahdollisesti aluksi kertakatetroimisen tarvetta. Robottiavusteisen leikkaustekniikan pienet, hyvin kääntyvät ja helposti liikuteltavat instrumentit helpottavat mm. uretereiden vapauttamista, virtsarakon irrottamista sekä riittävän parametrio- ja vaginamansetin saamista (kuva 6) (31).
Kohdunkaulan syövän tähystyskirurgiasta julkaistiin v. 2018 yllättäviä tuloksia (32,33), jotka poikkesivat aiempien retrospektiivisten tutkimusten tuloksista (34,35). Satunnaistetussa LACC-tutkimuksessa tähystysleikkauksiin liittyi suurempi syövän uusiutumis- ja kuolleisuusriski kuin avoleikkauksiin (32). Amerikkalaisessa rekisteritutkimuksessa tähystysleikkauksiin liitettiin huonompi ennuste, ja ASCO 2018 -kongressissa tämän tarkennettiin koskevan yli 2 cm:n tuumoreita (33).
FIN-GOG pienryhmä tutki tämän jälkeen retrospektiivisesti Suomen aineistot, eikä merkittävää eroa syövän uusiutumisessa eri leikkaustapojen välillä havaittu. Taudin uusiutumia todettiin enemmän pikemminkin avoleikkauksen jälkeen. Ulkomaisten tulosten aiheuttaman epävarmuuden jälkeen kohdunkaulan suurissa, yli 2 cm:n kasvaimissa on kuitenkin harkittu avoleikkausta (19). Uusia satunnaistettuja tutkimuksia aiheesta on jo käynnistetty (36).
Vuonna 2019 kohdunkaulan syövästä tehtiin eurooppalainen SUCCOR-monikeskustutkimus. Myös tässä tutkimuksessa uusiutumis- ja kuolemanriski olivat suuremmat tähystyskirurgian ryhmässä kuin avokirurgiassa yli 2 cm:n tuumoreissa. Uutena tietona havaittiin, että kohdun manipulaattorin käyttö leikkauksessa vaikuttaa riskiin. Jos tähystysleikkaus tehtiin ilman manipulaattoria, merkitsevää eroa ennusteessa ei leikkaustapojen välillä ollut. Tähystysleikattujen potilaiden syövän uusiutumisriski oli jopa pienempi kuin avoleikkausryhmässä, jos kohdunkaulan tuumori oli poistettu ennen leikkausta sähkösilmukkahoidolla tai jos se peitettiin leikkauksen alussa vaginan limakalvolla ja leikkaus tehtiin ilman manipulaattoria (37).
Munasarjasyöpä
Suomessa todettiin 549 uutta munasarja- tai munatorvisyöpää v. 2018. Munasarjasyövän suurin histologinen ryhmä (70 %) on high-grade seroosi. Suhteellinen elossaololuku on 5 vuoden kohdalla 44 % (16).
Munasarjasyöpä esiintyy yleisemmin postmenopausaalisilla naisilla, ja ensimmäisinä oireina ovat tyypillisesti 3–4 kuukautta kestäneet vatsakivut ja vatsan turvotus. Diagnoosivaiheessa mediaani-ikä on 63 vuotta. Sairastumisen riskiä pienentävät anovulaatiot, jotka voivat johtua raskauksista ja/tai ehkäisypillereiden käytöstä. Riskiä pienentävät myös munanjohtimien sulkeminen tai poisto (38).
Munasarjasyövän leikkaushoito on yleensä avoleikkaus, ja vain harvoissa tilanteissa käytetään tähystysleikkausta. Laparoskopia soveltuu uusintaleikkauksiin, joissa suoritetaan levinneisyystutkimus. Näissä tilanteissa munasarjakasvain on poistettu potilaalta jo aiemmassa leikkauksessa, mutta lopullisessa PAD-vastauksessa on yllättäen paljastunut munasarjasyöpä.
Uudessa leikkauksessa otetaan sytologinen näyte, tarkastetaan vatsaontelon pinnat ja tehdään lantion ja para-aortaalialueen imusolmukkeiden poisto sekä vatsapaidan ja umpilisäkkeen poisto. Tarkoituksena on selvittää, onko syöpä levinnyt poistetun munasarjan ulkopuolelle. Robottiavusteisella kirurgialla levinneisyysleikkaus saadaan tehtyä turvallisesti, potilas toipuu avoleikkausta nopeammin ja mahdollinen sytostaattihoitokin päästään aloittamaan nopeammin. Robottikirurgia soveltuu käytettäväksi vain alkuvaiheen munasarjasyövässä ja leikkauksissa, joissa syövän ei epäillä levinneen vatsakalvon pinnoille (39).
Lopuksi
Robottiavusteinen kirurgia on vakiintunut käyttöön gynekologisessa syöpäkirurgiassa. Suomalaisessa satunnaistetussa tutkimuksessa robottiavusteinen laparoskopia todettiin turvalliseksi ja tehokkaaksi leikkaustavaksi. Kohdunrunkosyöpäpotilailla robottiavusteinen tähystysleikkaus todettiin merkitsevästi (18 %) nopeammaksi – tosin myös 35 % kalliimmaksi – menetelmäksi kuin perinteinen laparoskopia (40). Kustannusten ero selittyi pääasiallisesti robottiavusteisen kirurgian kalliimmilla instrumenteilla ja laitteilla (41).
Tulevaisuudessa markkinakilpailun uskotaan pienentävän leikkausrobottien hintoja ja mahdollistavan leikkausindikaatioiden laajentamisen myös benigniin gynekologiaan, kuten esim. endometrioosin tai vaativan laskeumakirurgian hoitoon. Resurssien rajallisuus on tähän asti sallinut robottikirurgian käytön ensisijaisesti gynekologisten syöpäpotilaiden hoidossa tai muuten erityisen haastavissa tilanteissa. Sellaisiin lukeutuvat esim. leikkaukset, joissa konversion riski on suuri tai joita ei muuten saataisi tehtyä lainkaan, kuten erittäin ylipainoisten naisten leikkaukset.
Minna Mäenpää: Ei sidonnaisuuksia.
- 1
- Holloway RW, Patel SD, Ahmad S. Robotic Surgery in Gynecology. Scand J Surgery 2009; 98:96–109.
- 2
- Intuitive Surgical company. www.intuitivesurgical.com/company/profile.php
- 3
- Nezhat F. Minimally invasive surgery in gynecologic oncology: Laparoscopy versus robotics. Gynecol Oncol 2008;111:S29–32.
- 4
- Lowe MP, Johnson PR, Kamelle SA, Kumar S, Chamberlain DH, Tillmanns TD. A multiinstitutional experience with robotic-assisted hysterectomy with staging for endometrial cancer. Obstet Gynecol 2009;114:236–243.
- 5
- Seamon LG, Fowler JM, Richardson DL ym. A detailed analysis of the learning curve: Robotic hysterectomy and pelvic-aortic lymphadenectomy for endometrial cancer. Gynecol Oncol 2009;114:162–7.
- 6
- Mäenpää M, Nieminen K, Tomás E, Luukkaala T, Mäenpää JU. Implementing robotic surgery to gynecologic oncology: the first 300 operations performed at a tertiary hospital. Acta Obstet Gynecol Scand 2015;94:482–8.
- 7
- Lim PC, Kang E, Park DH. A comparative detail analysis of the learning curve and surgical outcome for robotic hysterectomy with lymphadenectomy versus laparoscopic hysterectomy with lymphadenectomy in treatment of endometrial cancer: A case-matched controlled study of the first one hundred twenty two patients. Gynecol Oncol 2011;120:413–8.
- 8
- Plerhoples TA, Hernandez-Boussard T, Wren SM. The aching surgeon: a survey of physical discomfort and symptoms following open, laparoscopic, and robotic surgery. J Robot Surg 2012;6:65–72.
- 9
- Catanzarite T, Tan-Kim J, Whitcomb EL, Menefee S. Ergonomics in Surgery: A Review. Female Pelvic Med Reconstr Surg 2018;24:1–12.
- 10
- Lee GI, Lee MR, Green I, Allaf M, Marohn MR. Surgeons’ physical discomfort and symptoms during robotic surgery: a comprehensive ergonomic survey study. Surg Endosc 2017;31:1697–1706.
- 11
- Van’t Hullenaar CD, Bos P, Broeders IA. Ergonomic assessment of the first assistant during robot-assisted surgery. J Robot Surg 2019;13:283–288.
- 12
- Oehler MK. Robot-assisted surgery in gynaecology. Australian and New Zealand Journal of Obstetrics and Gynaecology 2009;49:124–129.
- 13
- Cho JE, Nezhat FR. Robotics and Gynecologic Oncology: Review of the Literature. J Minim Invasive Gynecol 2009;16:669–681.
- 14
- Kristensen SE, Mosgaard BJ, Rosendahl M ym. Robot-assisted surgery in gynecological oncology: current status and controversies on patient benefits, cost and surgeon conditions - a systematic review. Acta Obstet Gynecol Scand 2017;96:274–285.
- 15
- Mäenpää M, Nieminen K, Tomás E, Luukkaala T, Mäenpää JU. Robotic-assisted infrarenal para-aortic lymphadenectomy in gynecological cancers: technique and surgical outcomes. Int J Gynecol Canc 2018;28:951–958.
- 16
- Suomen Syöpärekisteri. Syöpä 2018 -raportti (27.5.2020). https://syoparekisteri.fi/tilastot/tautitilastot/
- 17
- Colombo N, Creutzberg C, Amant F ym. ESMO-ESGO-ESTRO Endometrial Consensus Conference Working Group. ESMO-ESGO-ESTRO Consensus Conference on Endometrial Cancer: Diagnosis, Treatment and Follow-up. Int J Gynecol Canc 2016;26:2–30.
- 18
- Jang JW, Lee LJ. External beam, brachytherapy, or chemotherapy? Defining Adjuvant therapy for early -stage and high- and high-intermediate-risk endometrial cancer. J Clin Oncol 2019;37:1778–85.
- 19
- Suomen Gynekologiyhdistys. Suomen Gynekologisen Onkologian Erikoislääkärit (FIN-GOG). Kelpohoito suositukset FIN-GOG 2019 (9.12.2019). https://gynekologiyhdistys.fi/pienryhmat/onkologia/ sis.
- 20
- Persson J, Salehi S, Bollino M, Lönnerfors C, Falconer H, Geppert B. Pelvic Sentinel lymph node detection in High-Risk Endometrial Cancer (SHREC-trial) - the final step towards a paradigm shift in surgical staging. Eur J Cancer 2019;116:77–85.
- 21
- James JA, Rakowski JA, Jeppson CN, Stavitzski NM, Ahmed S, Holloway RW. Robotic transperitoneal infra-renal aortic lymphadenectomy in early-stage endometrial cancer. Gynecol Oncol 2015;136:285–292.
- 22
- Geppert B, Persson J. Robotic infrarenal paraaortic and pelvic nodal staging for endometrial cancer: feasibility and lymphatic complications. Acta Obstet Gynecol Scand 2015;94:1074–81.
- 23
- Ekdahl L, Salehi S, Falconer H. Improving Double Docking for Robot-assisted Para-aortic Lymphadenectomy in Endometrial Cancer Staging: Technique and Surgical Outcomes. J Minim Invasive Gynecol 2016;23:818–24.
- 24
- Paley PJ, Veljovich DS, Press JZ ym. A prospective investigation of fluorescence imaging to detect sentinel lymph nodes at robotic-assisted endometrial cancer staging. Am J Obstet Gynecol 2016;215:117.e7.
- 25
- Gaia G, Holloway RW, Santoro L, Ahmad S, Di Silverio E, Spinillo A. Robotic-Assisted Hysterectomy for Endometrial Cancer Compared With Traditional Laparoscopic and Laparotomy Approaches: A Systematic Review. Obstet Gynecol 2010;116:1422–1431.
- 26
- Salo H, Nieminen P, Kilpi T ym. Divergent coverage, frequency and costs of organised and opportunistic Pap testing in Finland. Int J Cancer 2014;135;204–213.
- 27
- Walboomers JM, Jacobs MV, Manos MM ym. Human papillomavirus in a necessary cause of invasive cervical cancer worldwide. J Pathol 1999;189:12–19.
- 28
- Veijalainen O, Kares S, Kujala P ym. Human papillomavirus test with cytology triage in organized screening for cervical cancer. Acta Obstet Gynecol Scand 2016;95:1220–1227.
- 29
- Sosiaali- ja terveysministeriö. Rokotusasetukseen muutoksia (20.3.2020). https://stm.fi/-/rokotusasetukseen-muutoksia-jatkossa-hpv-rokotteet-myos-pojille-ja-meningokokkirokotteet-riskiryhmille
- 30
- Cibula D, Pötter R, Planchamp F ym. ESGO-ESTRO-ESP Guidelines for the Management of Patients with Cervical Cancer. Int J Gyn Canc 2018;28:641–655.
- 31
- Shazly S, Murad MH, Dowdy SC, Gostout BS, Famuyide AO. Robotic radical hysterectomy in early stage cervical cancer: A systematic review and meta-analysis. Gynecol Oncol 2015;138:457–471.
- 32
- Ramirez P, Frumovitz M, Pareja R ym. Minimally invasive versus abdominal radical hysterectomy for cervical cancer. N Engl J Med 2018:379:1895–1904.
- 33
- Melamed A, Margul D, Chen L ym. Survival after minimally invasive radical hysterectomy for early-stage cervical cancer. N Engl J Med 2018;379:1905–1914.
- 34
- Wang YZ, Deng L, Xu HC, Zhang Y, Liang ZQ. Laparoscopy versus laparotomy for the management of early stage cervical cancer. BMC Cancer 2015 24;15:928.
- 35
- Sert BM, Boggess JF, Ahmad S ym. Robot-assisted versus open radical hysterectomy: A multi-institutional experience for early-stage cervical cancer. Eur J Surg Oncol 2016;42:513–22.
- 36
- Falconer H, Palsdottir K, Stalberg K ym. Robot-assisted approach to cervical cancer (RACC):an international multi-center, open-label randomized controlled trial. Int J Gynecol Canc 2019;29:1072–1076.
- 37
- Chiva L, Zanagnolo V, Querleu D ym. SUCCOR study: an international European cohort observational study comparing minimally invasive surgery versus open abdominal radical hysterectomy in patients with stage IB1 cervical cancer (painossa). Int J Gynecol Cancer 2020;30:1269–77. doi: 10.1136/ijgc-2020-001506
- 38
- Jayson GC, Kohn EC, Kitchener HC, Ledermann JA. Ovarian cancer. Lancet 2014;384:1376–88.
- 39
- Chen C-H, Chiu L, Chen H ym. Comparison of robotic approach, laparoscopic approach and laparotomy in treating epithelial ovarian cancer. Int J Med Robot 2016;12:268–75.
- 40
- Mäenpää MM, Nieminen K, Tomás EI, Laurila M, Luukkaala TH, Mäenpää JU. Robotic-assisted vs traditional laparoscopic surgery for endometrial cancer: a randomized controlled trial. Am J Obstet Gynecol 2016;215:588.e1–7.
- 41
- Vuorinen R-L, Mäenpää MM, Nieminen K ym. Costs of robotic-assisted versus traditional laparoscopy in endometrial cancer. Int J Gynecol Canc 2017;27:1788–1793.
Robotic-assisted surgery of gynaecological cancer
Robotic-assisted gynaecological laparoscopic surgery was approved for use in America in 2005, and has fast become more widely used globally since then. In Finland, it was taken into use in gynaecology in 2009. The technique is currently in use in every University Hospital in Finland and mostly for gynaecological cancers. Robotic-assisted surgery is especially well suited for the treatment of endometrial and cervical cancer as well as the treatment of early-stage ovarian cancer. Of these, high-risk endometrial cancer is an especially significant target group, in Finland eight out of ten operations are performed for this indication.
The main difference between robotic-assisted and traditional laparoscopy is that the surgeon does not touch the patient’s tissues him- or herself but uses a technical device which translates the surgeon’s actions into robotic movements. This technique requires three components: a robot, a console and the vision system. The robot, which has 4 movable arms, is attached to the trocars inserted in the patient’s abdominal cavity. A camera is attached to one robotic arm and surgical instruments are attached to the other three arms. The surgeon operates the robotic arms and instruments attached to them by means of the handles and foot pedals in the console. The electric current is also selected with foot pedals.
Robotic-assisted surgery has certain special characteristics: it offers a 3D view, excessive movements are filtered out, robot hands are tireless, the tips of surgical instruments are small, the movement of the instruments is similar to the hand wrist movements of the surgeon in open operations, the camera is stable and stays in the desired position.
Further special characteristics of robotic-assisted surgery are the minor bleeding, quick recovery and small risk of conversion to open surgery and complications. The technique is very suitable for the surgical treatment of patients with gynaecological cancer, operations have been effective and are safe to perform.