ApoE liittyy moniin sairauksiin
APOE-geenin säätelemä apolipoproteiini apoE on tärkeä kolesteroli- ja rasva-aineenvaihdunnassa, keskushermoston säätelyssä, immuunivasteessa sekä monissa solujen toiminnoissa.
Geeni on vain ihmisellä polymorfinen. Kolmesta ilmiasusta apoE3 on maapallolla tavallisin (59–90 %) ja apoE2 harvinaisin. ApoE4-muotoa esiintyy Suomessa paljon, yli 30 %:lla.
ApoE4 yhdistyy monien myöhemmällä iällä ilmaantuvien sairauksien, muun muassa Alzheimerin taudin riskiin, mutta yleensä tarvitaan myös muita samanaikaisia tekijöitä.
Kliinisesti apoE-ilmiasun määrityksestä voi olla hyötyä riskin arvioinnissa, ja apoE saattaa olla jatkossa myös terapian kohde.

Apolipoproteiinit (apo) tekevät rasvaa sisältävien lipoproteiinien kuljetuksen mahdolliseksi verenkierrossa. Tällä hetkellä tunnetaan useita muotoja (apoA, apoB jne.) ja niille vielä alalajeja, joilla on erilaisia tehtäviä rasva-aineenvaihdunnassa. Vuonna 2023 tulee kuluneeksi 50 vuotta apolipoproteiini E:n (apoE) löytämisestä (1). Ihmisellä se tunnistettiin ensin osana VLDL-partikkelia ja nimettiin aluksi sen sisältämän arginiiniaminohapon takia “arginine-rich” apoproteiiniksi. ApoE-nimeä on käytetty vuodesta 1975 (2).
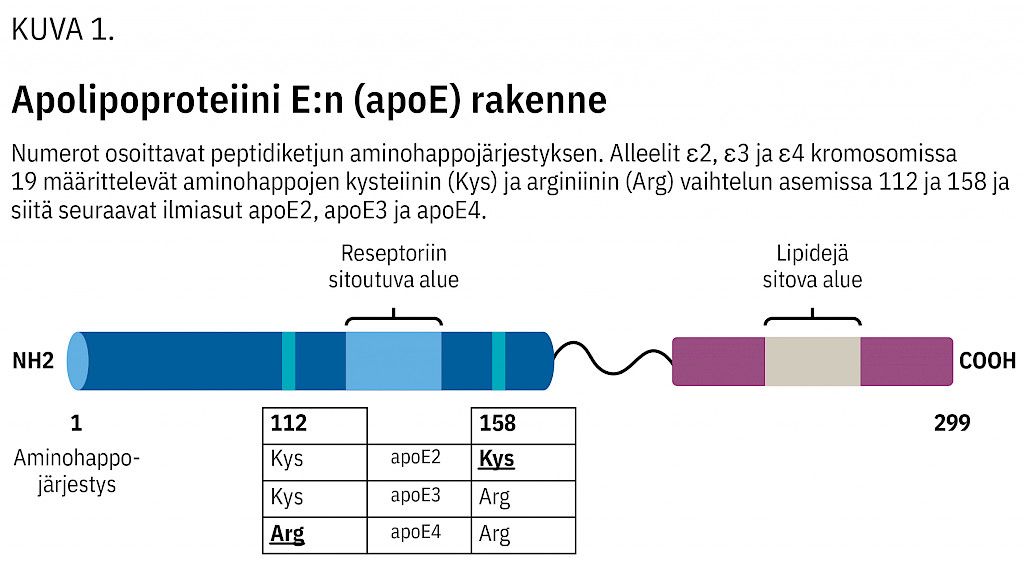
ApoE on 34 kDa:n suuruinen glykoproteiini, joka voi siirtyä verenkierrossa lipoproteiinista toiseen. Se on tärkeä etenkin jäännöslipoproteiinien ja kolesterolin metaboliassa ja merkittävin apolipoproteiini keskushermostossa. ApoE-peptidiketju koostuu 299 aminohaposta, jotka sijoittuvat kahteen osaan sisältäen reseptoriin ja lipideihin sitoutuvat alueet (kuva 1). Aminohappoerot asemissa 112 ja 158 määräävät apoE:n ilmiasun (3, ks. edempänä).
ApoE:n tekevät tieteellisesti ja kliinisesti mielenkiintoiseksi sen geneettinen polymorfia, monipuoliset fysiologiset tehtävät soluissa ja solujen ulkopuolella sekä monet yhteydet keskeisiin sairauksiin, kuten valtimotauteihin, Alzheimerin tautiin ja tulehdus-immuunisairauksiin. ApoE:sta on äskettäin julkaistu perusteellisia katsauksia (4,5,6), jotka ovat tässä apoE-metabolian yleisviitteinä.
ApoE:n tehtävät
Verenkierrossa
Hiussuonten lipoproteiinilipaasi hajottaa ravinnon rasvoja suolesta kuljettavia kylomikroneita, ja maksa kerää tämän seurauksena syntyvät kylomikronijäännökset (7). Niihin tarttuu verenkierrossa tai maksasolujen pinnalla apoE:ta, jota tarvitaan jäännösten siirtoon maksasoluihin joko LDL-reseptorien tai solukalvon heparaanisulfaatin välityksellä. Aminohappoerot apoE:n rakenteessa vaikuttavat sen laskostumiseen ja sitä kautta sitoutumiseen reseptoriin. Tällä on merkitystä niin sanotun jäännöshyperlipidemian synnyssä ja kliinisessä merkityksessä (ks. edempänä).
Ulos maksasta apoE liikkuu pääosin VLDL-partikkeleissa ja kehon ääriosista maksaan HDL:n mukana, edesauttaen näin kolesterolin takaisinkuljetusta. ApoE kiinnittyy solukalvon LDL-reseptoreihin ja kolesteroli siirtyy solusta ATP:tä sitovan kasettikuljetin ABCA1:n avulla. Rasvametabolian lisäksi apoE osallistuu myös tulehduksen ja immuunivasteen säätelyyn (4,5,6).
Soluissa
Suurin osa verenkierron apoE:sta on peräisin maksasta, mutta 20–40 % muodostuu muissa kudoksissa: makrofageissa, rasvasoluissa, astrosyyteissä, mikrogliasoluissa, neuroneissa ja epiteelisoluissa, joissa apoE säätelee solutoimintoja auto- ja parakriinisin mekanismein (4,5,6). Tämä johtaa moniin fysiologisiin ja patologisiin vaikutuksiin. ApoE:n tärkeästä fysiologisesta merkityksestä kertoo se, että koe-eläimillä APOE-geenin poisto johtaa vaikeisiin häiriöihin muun muassa keuhkoissa ja maksassa.
ApoE ihmisellä
ApoE:tä esiintyy kaikilla selkärankaisilla. Ihmisessä sen vaikutuksia monimutkaistaa APOE-geenin polymorfia (3,6,7). Tätä ainutlaatuisuutta ei tavata edes Homo sapiensin lähimmillä edeltäjillä. Ihmisen APOE-geeni sijaitsee kromosomissa 19, ja haplotyypin mutaatiot eksonissa 4 ovat johtaneet kolmeen tavallisimpaan alleeliin: ε2, ε3 ja ε4 (3). Näiden yhdistelmät ε2/ε2, ε2/ε3 ja ε2/ε4 tuottavat ilmiasun apoE2, ε3/ε3 on apoE3 ja ε2/ε4, ε3/ε4 ja ε4/ε4 ovat apoE4. Yleisimmän alleelin ε3 peptidiketjussa asemassa 112 on kysteiini ja asemassa 158 arginiini, ε2:ssa kummassakin on kysteiini ja ε4:ssa arginiini. Nämä yksinkertaiset erot johtavat merkittäviin eroihin ilmiasujen toiminnassa.
Tietoja nykyväestöjen apoE-ilmiasujen suhteista on useissa lähteissä (8,9,10). ApoE3 on tavallisin, 60–90 %, ja ApoE4:n esiintyvyys kasvaa Euroopassa pohjoiseen siirryttäessä, esimerkiksi Kreikan 9 %:sta Suomen yli 30 %:iin (8); näistä ε4/ε4-homotsygootteja on arviolta 170 000. Myös Afrikassa ja useilla alkuperäiskansoilla apoE4:n osuus on suuri, jopa 40 % (9). ApoE2:n osuus on kaikissa väestöissä pienin, 0–8 %. Suomessa osuus on noin 7 %, ja jäännöshyperlipidemialle alttiita ε2/ε2-homotsygootteja on 0,2 % eli noin 10 000 henkilöä.
Ilmiasuista apoE4 (varsinkin homotsygoottimuoto ε4/ε4) on yhdistetty negatiivisiin ja apoE2 usein positiivisiin terveysvaikutuksiin (4,5,6). Niitä on liitetty keskeisiin kroonisiin sairauksiin, aivotoiminnan häiriöihin ja vanhenemisilmiöön. Ilmiasu vaikuttaa myös infektioherkkyyteen ja -komplikaatioihin, esimerkkinä äskettäin todettu yhteys apoE4:n ja COVID-19-sairauden välillä (11).
ApoE:n polymorfiaan on kohdistunut suuri tutkimuskiinnostus myös siksi, että se avaa näkökulmia ihmisen evoluutioon (6).
Evoluution vaikutus
Rakenteeltaan apoE4 on lähinnä alkuperäistä eläimillä esiintyvää muotoa (joskin se vastaa toiminnallisesti lähinnä ihmisen apoE3:a). Seuraavana ilmaantui apoE3 ja lopuksi apoE2 (6). Koska nimenomaan apoE4 yhdistyy moniin ihmisellä keski-iän jälkeen yleistyviin pitkäaikaissairauksiin, tämän ilmiasun alkuperäisyys – ja myös säilyvyys – voi tuntua oudolta. Evoluution kannalta keskeistä on kuitenkin jälkeläisten tuottaminen, ja näin apoE4:n voi olettaa antavan etuja, kuten infektioiden vastustuskykyä (12), nuoremmalla iällä. Etenkin nykyisissä hyvinvointiyhteiskunnissa edut sitten kääntyvät negatiivisiksi iän karttuessa (antagonistinen pleiotropia). Näin apoE-tutkimus voi auttaa myös ikääntymisilmiön (seneskesenssi) tutkimusta.
Tarkat mekanismit ovat vielä pitkälti epäselviä, mutta yleisiä linjoja polymorfian kehittymiseen voi etsiä nykyihmisen evoluutiossa ja muotoutumisessa keskeisistä tekijöistä, kuten ravitsemuksen määrän ja laadun (lihansyönti) muutoksista, eliniän pitenemisestä hedelmällisen ajan yli ja infektioille altistumisesta. Niin sanotulla isoäitihypoteesilla – vanhempi sukupolvi auttaa lastenlasten selviämistä – on koetettu selittää pidempään elinkaareen liittyvien apoE2- ja apoE3-ilmiasujen kehittymistä (13).
Sydän- ja verisuonisairaudet
Jo varhain todettiin, että apoE liittyy valtimosairauksien ja ateroskleroosin riskiin. ApoE4:n riskiä lisäävä vaikutus selittyy luontevasti sen vaikutuksilla kolesterolin aineenvaihduntaan: tehokkaampaan kolesterolin imeytymiseen ja LDL-reseptorivaikutuksiin ja sitä kautta korkeampaan plasman kolesterolipitoisuuteen (mm. 7,8). ε2/ε2-homotsygotia puolestaan altistaa jäännöshyperlipidemian (tyyppi III) synnylle, joskaan se ei yksin riitä. ApoE:lla on myös lukuisia muita vaikutuksia endoteelin toimintaan ja ateroskleroosin patogeneesiin, kuten tulehdusalttiuteen (5). Näissä apoE4 on pääsääntöisesti haitallisempi kuin muut ilmiasut (5).
Aivotoiminta
ApoE:n toiminta keskushermostossa on ollut kiivaan tutkimuksen kohteena, ja tuloksia on seikkaperäisesti kuvattu tuoreessa katsauksessa (6). Normaalitilanteessa pääosin maksassa tuotettu plasman apoE ei läpäise veri-aivoestettä, vaan keskushermoston apoE on pääosin astrosyyttien tuottamaa.
ApoE:llä on keskushermostossa useita tehtäviä, jotka liittyvät synapsien toimintaan, astrosyyttien lipidimetaboliaan, mikroglian välittämään tulehdus- ja immuunivasteeseen sekä solujen väliseen kommunikaatioon. ApoE4 suoriutuu näistä tehtävistä huonommin kuin apoE3 tai apoE2. Se altistaa beeta-amyloidin kertymiselle, tau-proteiinin patologialle sekä neuroinflammaatiolle, jotka kaikki liittyvät Alzheimerin taudin kehittymiseen. Lisäksi apoE4:ään liittyvä suurentunut valtimotauti- ja ateroskleroosiriski, muun muassa kaulavaltimoissa, voi lisätä ainakin sekamuotoisen muistisairauden riskiä.
Mielenkiintoinen mekanismi on heikentynyt puolustus tiettyjä keskushermostoinfektioita kohtaan: apoE4 lisää herkkyyttä HSV-1-viruksen aktivaatiolle (14) ja tätä kautta voi aiheuttaa toistuvia inflammaatiovaiheita. Veri-aivoesteen pitävyys on tärkeää aivojen normaalille toiminnalle, ja sen heikentyminen on varhainen kognitiivisen heikentymisen osoitin. ApoE4 näyttää altistavan veri-aivoesteen pettämiselle, ja tämä on riippumaton Alzheimerin tautiin liittyvästä amyloidi- ja tau-patologiasta (15).
Kaiken tämän perusteella ei ole ihme, että apoE4 altistaa kognition heikentymiselle ja on merkittävin myöhemmällä iällä ilmaantuvan sporadisen Alzheimerin taudin geneettinen riskitekijä (6,16). Heterotsygoottisena se suurentaa riskin noin kaksin–kolminkertaiseksi, suunnilleen saman verran kuin keski-iän korkea kolesteroli tai korkea systolinen verenpaine (17). ε4/ε4-homotsygotiaan liittyvä Alzheimerin taudin riski on 9–15-kertainen verrattuna ε3/ε3:een; ε2/ε2:een puolestaan liittyy pienentynyt riski. ApoE4 lisää myös Parkinsonin taudin riskiä, mutta siinä apoE2 ei näyttäydy suojaavana (5).
Immuniteetti ja infektiot – COVID-19
ApoE sitoutuu epäspesifisti, mutta herkästi useisiin tulehdusta välittäviin tekijöihin, muun muassa beeta-amyloidiin, lipopolysakkarideihin ja beetaglukaaniin. Se auttaa näin ensilinjan immuunipuolustusta tunnistamaan ja torjumaan patogeenisia mikrobeja. ApoE4 näyttää joissakin tapauksissa toimivan suojaavana, esimerkkinä suolistoinfektiot, parasiitit ja C-hepatiittivirus (12,18), joissakin haitallisena (4). Viimeksi mainitusta tuore esimerkki on COVID-19-tautia aiheuttava SARS-CoV-2.
ApoE ja COVID-19
Sekä brittiläisessä (19) että suomalaisessa tutkimuksessa (20) apoE4, etenkin sen homotsygoottimuoto, on liittynyt vaikeampaan COVID-19-tautiin ja sen jälkeiseen väsymisoireeseen. Mahdollisia mekanismeja on lueteltu taulukossa 1. Tulevaisuus näyttää, lisääkö pitkittynyt COVID-19 myös muistisairauksien riskiä ja mikä siinä on apoE4:n osuus.
Muita sairauksia
ApoE:lla on todettu yhteyksiä useisiin muihin sairauksiin, joiden patogeneesissä kolesterolimetabolialla, verisuonimuutoksilla ja/tai inflammaatiolla on merkitystä. Näitä on esimerkinomaisesti lueteltu taulukossa 2 (3,4,17,18,19,20). Usein apoE4 näyttäytyy näissä haitallisena, mutta joissain tapauksissa suojaavana.
Vanheneminen
ApoE on harvoja geneettisiä tekijöitä, joiden on useimmissa tutkimuksissa todettu liittyvän pitkäikäisyyteen (26). ApoE4 harvinaistuu ja ApoE2 yleistyy 100-vuotiailla (27), ja todennäköisenä mekanismina on erilainen alttius tappaville sairauksille aiemmin elämässä. Geenit siis ennemminkin edesauttavat elonjäämistä kuin ikääntymistä sellaisenaan.
ApoE diagnostiikassa ja hoidossa
Vaikka apoE-tyypin määritys on ollut vuosia rutiininomaisesti saatavissa, sen käyttöön esimerkiksi muistisairauden diagnostiikassa on suhtauduttu varauksin. Järkeenkäypänä perusteena on ollut se, että geenityyppiä ei voi muuttaa ja apoE4 on vain yksi osa yleensä monitekijäistä sairautta, johon ei ole olemassa parantavaa hoitoa. ApoE4 ei yksin aiheutakaan ongelmaa, vaan tarvitaan muita myötävaikuttavia tekijöitä (”multi hit”) (28,29). Tilanne eroaa esimerkiksi familiaalisen hyperkolesterolemian geenidiagnostiikasta. Vaikka geeniin ei vaikutetakaan, sen seurausta (hyperkolesterolemia) voidaan menestyksellisesti hoitaa ja potilaan ennustetta parantaa (30).
ApoE4 kuitenkin liittyy sairauksiin, joissa elintapamuutoksilla ja riskitekijöiden hoidolla on saatavissa positiivisia tuloksia. Tällä perusteella tietoisuus geneettisen riskin olemassaolosta voisi paremmin motivoida ja parantaa huonoa hoitoon sitoutumista, joka on merkittävä ongelma sairauksien ehkäisyssä (31). Rohkaisevia ovat havainnot liikunnasta (32) sekä terveellistä Välimeren ruokavaliota noudattavista väestöistä (33), joissa apoE4 ei näytäkään haitalliselta tai vaikuta kognition heikentymistä estävän intervention tehoon (34). Erikoistapaus ovat apoE2-homotsygootit, joiden on jäännöshyperlipidemian estämiseksi syytä välttää muita sille altistavia tekijöitä, kuten lihomista (35). COVID-19-potilailla apoE-tyypin määritystä voisi käyttää riskinarviossa, mutta tästä ei vielä ole tutkimuksia.
Esikliinisiä tutkimuksia on jo runsaasti siitä, miten apoE:n hyviä ominaisuuksia voitaisiin hyödyntää pienillä apoE-mimeeteillä esimerkiksi kolesterolin takaisinkuljetuksessa ja aivosairauksissa. Etenkin apoE4:ään liittyviä haittoja voisi olla mahdollista poistaa sen rakennetta muuttamalla, antisense-oligonukleotidi- tai geeniterapialla. Haasteita ovat kuitenkin hoidon turvallisuus ja hoidon kohdistaminen oikeisiin kudoksiin ja solutyyppeihin (5,6).
Timo Strandberg: Konsultointipalkkiot (useita lääkeyhtiöitä, mm. Amgen, Novartis, Orion Pharma, Pfizer, Sankyo, Sanofi), Dyslipidemian Käypä hoito -suositusryhmän pj.
- 1
- Shore VG, Shore B. Heterogeneity of human plasma very low density lipoproteins. Separation of species differing in protein components. Biochemistry 1973;12:502–7.
- 2
- Utermann G. Isolation and partial characterization of an arginine-rich apolipoprotein from human plasma very-low-density lipoproteins: apolipoprotein E. Hoppe Seylers Z Physiol Chem 1975;356:1113–21.
- 3
- Rall S C Jr, Weisgraber KH, Mahley RW. Human apolipoprotein E. The complete amino acid sequence. J Biol Chem 1982;257:4171–8.
- 4
- Martínez-Martínez AB, Torres-Perez E, Devanney N ym. Beyond the CNS: The many peripheral roles of APOE. Neurobiol Dis 2020;138:104809. DOI: 10.1016/j.nbd.2020.104809.
- 5
- Alagarsamy J, Jaeschke A, Hui DY. Apolipoprotein E in cardiometabolic and neurological health and diseases. Int J Mol Sci 2022;23:9892. DOI: 10.3390/ijms23179892
- 6
- Fernández Calle R, Konings SC, Frontiñán Rubio J ym. APOE in the bullseye of neurodegenerative diseases: impact of the APOE genotype in Alzheimer’s disease pathology and brain diseases. Molecular Neurodegeneration 2022;17:62. doi.org/10.1186/s13024-022-00566-4
- 7
- Kovanen PT, Viikari J. Dyslipidemiat. Kirjassa: Välimäki M, Sane T, Dunkel L, toim. Endokrinologia, 1. painos. Helsinki: Duodecim 2000;620–82.
- 8
- Lehtimäki T, Moilanen T, Viikari J ym. Apolipoproteiini E:n geneettinen vaihtelu ja seerumin kolesteroli suomalaisilla lapsilla ja nuorilla. Duodecim 1994;110:1313–7.
- 9
- Corbo RM, Scacchi R. Apolipoprotein E (APOE) allele distribution in the world. Is APOE*4 a 'thrifty' allele? Ann Hum Genet 1999;63:301–10. DOI: 10.1046/j.1469-1809.1999.6340301.x
- 10
- Singh PP, Singh M, Mastana SS. APOE distribution in world populations with new data from India and the UK. Ann Hum Biol 2006;33:279–308. DOI: 10.1080/03014460600594513
- 11
- Gkouskou K, Vasilogiannakopoulou T, Andreakos E ym. COVID-19 enters the expanding network of apolipoprotein E4-related pathologies. Redox Biol 2021;41:101938. DOI: 10.1016/j.redox.2021.101938
- 12
- Freitas RS, Roque CR, Matos GA ym. Immunoinflammatory role of apolipoprotein E4 in malnutrition and enteric infections and the increased risk for chronic diseases under adverse environments. Nutr Rev 2022;80:1001–12.
- 13
- Finch CE, Sapolsky RM. The evolution of Alzheimer disease, the reproductive schedule, and apoE isoforms. Neurobiol Aging 1999;20:407–28.
- 14
- Itzhaki R, Wozniak M. Susceptibility to herpes simplex labialis conferred by the gene encoding apolipoprotein E. J Infect Dis 2008;198:624–5.
- 15
- Montagne A, Nation DA, Sagare AP ym. APOE4 leads to blood-brain barrier dysfunction predicting cognitive decline. Nature 2020;581:71–6.
- 16
- Tilvis RS, Strandberg TE, Juva K. Apolipoprotein E phenotypes, dementia and mortality in a prospective population sample. J Am Geriatr Soc 1998;46:712–5.
- 17
- Kivipelto M, Helkala EL, Laakso MP ym. Apolipoprotein E epsilon4 allele, elevated midlife total cholesterol level, and high midlife systolic blood pressure are independent risk factors for late-life Alzheimer disease. Ann Intern Med 2002;137:149–55.
- 18
- James MW, Ryder SD, Irving WL; Trent HCV Study Group. Apolipoprotein E-epsilon 4 protects against severe liver disease caused by hepatitis C virus. Hepatology 2002;36:456–63.
- 19
- Kuo CL, Pilling LC, Atkins JL ym. ApoE e4e4 genotype and mortality with COVID-19 in UK Biobank. J Gerontol A Biol Sci Med Sci 2020;75:1801–3.
- 20
- Kurki SN, Kantonen J, Kaivola K ym. APOE ε4 associates with increased risk of severe COVID-19, cerebral microhaemorrhages and post-COVID mental fatigue: a Finnish biobank, autopsy and clinical study. .Acta Neuropathol Commun 2021;9:199. DOI: 10.1186/s40478-021-01302-7
- 21
- Libby P, Lüscher T. COVID-19 is, in the end, an endothelial disease. Eur Heart J 2020;41:3038–44. DOI: 10.1093/eurheartj/ehaa623
- 22
- Karim S, Burns A. The biology of psychosis in older people. J Geriatr Psychiatry Neurol 2003;16:207–12.
- 23
- Xianglan Yao 1, Cuilian Dai, Karin Fredriksson ym. Human apolipoprotein E genotypes differentially modify house dust mite-induced airway disease in mice. Am J Physiol Lung Cell Mol Physiol 2012;302:L206–15.
- 24
- Ghosh S, Rihan M, Ahmed S ym. Immunomodulatory potential of apolipoproteins and their mimetic peptides in asthma: Current perspective. Respir Med 2022;204:107007.
- 25
- Lozupone M, Donghia R, Sardone R ym. Apolipoprotein E genotype, inflammatory biomarkers, and non-psychiatric multimorbidity contribute to the suicidal ideation phenotype in older age. The Salus in Apulia Study. J Affect Disord 2022;319:202–12.
- 26
- Caruso C, Ligotti MA, Accardi G, ym. How important are genes to achieve longevity? Int J Mol Sci 2022;23:5635. DOI: 10.3390/ijms23105635
- 27
- Louhija J, Miettinen HE, Kontula K, Tikkanen MJ, Miettinen TA, Tilvis RS. Aging and genetic variation of plasma apolipoproteins. Relative loss of the apolipoprotein E4 phenotype in centenarians. Arterioscler Thromb 1994;14:1084–9.
- 28
- Strandberg TE, Pitkälä K, Eerola J, Tilvis R, Tienari PJ. Interaction of herpesviridae, APOE gene, and education in cognitive impairment. Neurobiol Aging 2005;26:1001–4.
- 29
- George Steele O, Cameron Stuart A, Minkley L ym. A multi-hit hypothesis for an APOE4-dependent pathophysiological state. Eur J Neurosci 2022;56:5476–515.
- 30
- Loh WJ, Watts GF. The inherited hypercholesterolemias. Endocrinol Metab Clin North Am 2022;51:511–37.
- 31
- Huupponen R, Strandberg T. Miten auttaa potilasta sitoutumaan lääkehoitoonsa? Duodecim 2020;136:223–7.
- 32
- Perez-Lasierra JL, Casajús JA, Casasnovas JA ym. Can physical activity reduce the risk of cognitive decline in apolipoprotein e4 carriers? A Systematic Review. Int J Environ Res Public Health 2021;18:7238. DOI: 10.3390/ijerph18147238
- 33
- Dhana K, Aggarwal NT, Rajan KB ym. Impact of the aolipoprotein E ε4 allele on the relationship between healthy lifestyle and cognitive decline: A population-based study. Am J Epidemiol 2021;190:1225–33.
- 34
- Solomon A, Turunen H, Ngandu T ym. Effect of the Apolipoprotein E genotype on cognitive change during a multidomain lifestyle intervention: A subgroup analysis of a randomized clinical trial. JAMA Neurol 2018;75:462–70.
- 35
- Kim H, Devanand DP, Carlson S, Goldberg TE. Apolipoprotein E genotype e2: Neuroprotection and its limits. Front Aging Neurosci 2022;14:919712. DOI: 10.3389/fnagi.2022.919712
ApoE is associated with several diseases
Apolipoprotein E (apoE), regulated by the APOE gene, is important in cholesterol and lipid metabolism, brain function, immune response and in many cell functions. Only in humans is the APOE gene polymorphic; of the 3 phenotypes, apoE3 is the most prevalent, in 59–90%, followed by apoE4. In Finland, apoE4 is particularly prevalent, in >30%. While apoE4 may be beneficial in childhood, in adults apoE4 is associated with a risk of several chronic diseases including Alzheimer disease and cardiovascular disease. However, other risk factors are usually also needed. Clinically, apoE typing may be useful for risk assessment, and therapeutic possibilities related to apoE are also being investigated.
Timo Strandberg
M.D., Ph.D., Emeritus Professor of Geriatrics
HUS, Internal Medicine and Rehabilitation, and University of Helsinki
University of Oulu, Center for Life Course Health Research